自己組織化変異ペプチドによる グラファイトの分子認識を解明!
金沢大学ナノ生命科学研究所(WPI-NanoLSI)のアイハン・ユルトセベル特任助教と福間剛士教授らの研究グループは,アメリカ・ワシントン大学の研究グループと共同で,グラファイト固体表面におけるペプチドの自己組織化構造を,液中周波数変調原子間力顕微鏡(FM-AFM)(※1)により分子レベルで可視化することに成功しました。これにより,グラファイトに対するペプチドの分子認識の一端が解明されました。
生体要素の一種であるペプチドは,操作・設計・利用の容易さから,ナノバイオデバイスとしての利用が模索されています。ペプチドの性質のさらなる向上や実用化のために,その構造や挙動,機能を分子レベルで明らかにすることが望まれています。しかしながら,従来はこれらを直接解析できる計測技術がなく,その詳細はよく知られていませんでした。
本研究では,金沢大学のグループがこれまでに開発した,物質の表面構造を分子スケールで観察できるFM-AFMを用いて,2種類の変異ペプチドを水の中で観察し,その表面を分子レベルで可視化することに成功しました。これらのペプチドは, 逆の電気的性質を有するにもかかわらず,いずれもグラファイト表面に吸着構造を形成し,加えてグラファイト表面の原子スケール構造に応じて,これらのペプチドが異なる吸着構造をとることを明らかにしました。さらに,分子動力学シミュレーションによる解析と組み合わせることで,他の生体システムでは見られないような生体/固体のハイブリッド界面を形成することを初めて明らかにしました。
これらの知見は,ナノバイオ/固体界面の設計に向けた重要な一歩であり,分子基盤デバイスの多様性を飛躍的に広げることが期待されます。
本研究成果は,2024年2月22日に国際学術誌『Small』のオンライン版に掲載されました。
研究の背景
タンパク質は,生物学における重要な分子構成要素であり,酵素機能を発揮し,イオンや電子を輸送し,さらに細胞構造の主要な基盤を構成しています。タンパク質の機能は,それらのアミノ酸が持つ配列に依存していることから,アミノ酸配列がタンパク質の三次元分子構造を決定しています。タンパク質のアミノ酸の数は,数百から数千程度であり,特殊な細胞の遺伝子(DNA)によって編成(コード)されています。そのため,アミノ酸配列に何らかの異常があると,タンパク質の分子構造に影響を及ぼし,それが機能に反映され,しばしば遺伝病を引き起こすと予想されています。また,人工タンパク質による材料・デバイスへの応用も模索されていますが,その大きさから合成は難しく実用化が困難とされています。
タンパク質と同様に,ペプチドもアミノ酸から構成され,それぞれ固有の配列を持っています。ペプチドもDNAによって配列がコードされますが,その長さはアミノ酸10~30個分程度と非常に短いことが特徴です。タンパク質よりもはるかに小さいことから,ペプチドは操作・設計・利用が非常に容易とされています。従って,バイオセンサやバイオエレクトロニクスといった生物学の知見に基づく技術を,分子スケールで実現するためには,ペプチドを用いた基礎科学を確立することが不可欠と言えます。アメリカ・ワシントン大学のサリカヤ教授は,この前提をもとに,遺伝子工学,分子生物学,情報学,機械学習,材料科学・工学を含む新しい収束科学のアプローチを固体結合ペプチドの設計に導入し,実用的なハイブリッド技術への利用を実証しています。これまでに,グラファイト結合ペプチドとして特別にデザインされたペプチドの一種を,二つの異なるペプチドに変異させました。どちらも分子量や大きさは同じですが,荷電アミノ酸の点変異による影響で,一つは負,もう一つは正に帯電しています。予想通り,両者は異なる機能を持ち,実際に作用していました。しかし,これらのペプチドが互いに,また変異前のペプチドと,具体的にどのように異なる作用を示すのかなど、それらの分子構造の詳細や,グラファイト基板表面での挙動については未解明のまま残されています。それゆえ,これまで変異体とその予測可能な挙動との関係の理解は限られており,所望の挙動に即したペプチドを設計することが困難でした。これを解決するためには,数秒から数時間にわたる水中での分子の本来の状態を,非常に高解像度で直接観察する必要があります。
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の福間剛士教授らの研究グループでは,液中環境下において,物質の表面構造を分子スケールで観察できる周波数変調原子間力顕微鏡(FM-AFM)の技術開発や応用研究に長年取り組んできました。本研究では,これらの技術を用いて,水中におけるペプチドの構造や自己組織化過程の分子スケール観察を実施しました(図1a)。
研究成果の概要
本研究グループは,液中FM-AFMにより,ペプチド変異体の挙動を詳細に明らかにし,材料科学から物理学,化学,生物学にまたがる幅広い領域で,意義深い結果を得ることに成功しました。第一に,変異ペプチドは個々に異なる電荷を持っているにもかかわらず,いずれもグラファイト表面に結合するだけでなく,集合し,単一分子の厚さのペプチド結晶を形成しました。ただし,負に帯電したペプチドは,互いに巻き付いた二つの分子による斜め格子を形成したのに対し,正に帯電したものは一つのペプチドを含む別の斜め格子を形成していました。特筆すべきこととして,これらのペプチドの挙動が,分子動力学シミュレーションを使ってモデル化された分子構造と,単純かつ直接的に関連していることが挙げられます。これにより,いずれのペプチドについても,グラファイト基板の六角形格子とのキラルな関係で,定量的に表現できることが分かりました。これは各ペプチドが,グラファイトとハイブリッド界面を形成していることを意味し,生物学におけるリガンド-受容体相互作用や,タンパク質-DNA相互作用とは異なり,これらの間に顕著な空間がないと言えます。
今後の展開
「生きている」分子による固体物体の分子認識は,これまではっきりと観察されたことはなく,またその詳細がキラルであると説明されたこともありませんでした。本研究から,突然変異がどのように分子の形態変化をもたらし,その結果ペプチドの機能がどのように変化するかについての十分なデータと詳細が得られました。さらに,本研究で明らかとなったハイブリッド界面の形成については,ナノスケールの生体・非生体物体が同じソフト界面に安定的に存在し,一貫した分子ブリッジを形成していることを示唆しています。本研究により,変異という単純な分子生物学的手段を用いることで,将来のナノバイオ/固体界面における分子基盤デバイスのレパートリーを飛躍的に広げることが期待されます。
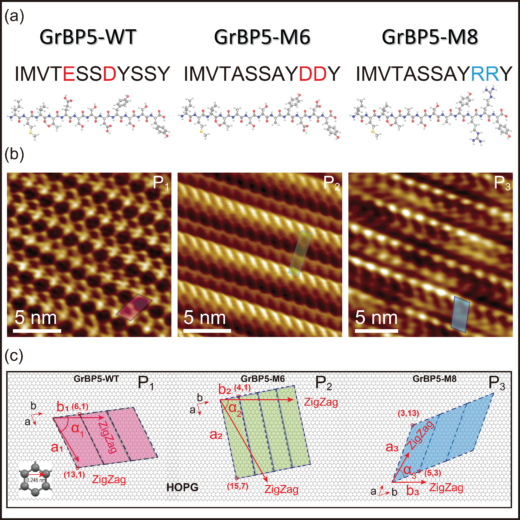
図1. ペプチドの分子特性と自己組織化(a)本研究成果で利用したペプチドの化学構造。GrBP5-WT:野生型。GrBP5-M6:変異体,負に帯電している。GrBP5-M8:変異体,正に帯電している。(b)規則的に並んでいるペプチド結晶の高分解能AFM像。(c)グラファイト(0001)面の炭素原子に形成するペプチド結晶の結晶学的配向関係。 © 2024 Yurtsever, et al., Small published by Wiley-VCH GmbH
用語解説
掲載論文情報
- 論文タイトル
- Dynamics of Molecular Self-Assembly of Short Peptides at Liquid-Solid Interfaces – Effect of Charged Amino Acid Point Mutations (固液界面における短いペプチドの分子自己集合のダイナミクス―荷電アミノ酸点変異の効果)
- 著者
- Ayhan Yurtsever, Kaito Hirata, Ryohei Kojima, Keisuke Miyazawa, Kazuki Miyata, Sanhanut Kesornsit, Hadi Zareie, Linhao Sun, Katsuhiro Maeda, Mehmet Sarikaya, Takeshi Fukuma (アイハン・ユルトセベル,平田海斗,児島亮平,宮澤佳甫,宮田一輝,サンハナット・ゲーソンシット,ハディ・ザレイエ,リンハオ・スン,前田勝浩,メフメト・サリカヤ,福間剛士)
- 掲載誌
- Small
- 掲載日
- 2024.02.22
- DOI
- 10.1002/smll.202400653
- URL
- https://doi.org/10.1002/smll.202400653

