α-ヘリックスの「ホチキス留め」: 片手型のアミノ酸なしで一方向巻きらせんの構築に成功!
金沢大学ナノ生命科学研究所 (WPI-NanoLSI) の逢坂直樹特任助教,秋根茂久教授,ナノ生命科学研究所 (WPI-NanoLSI) の海外PIで,カナダ・ブリティッシュコロンビア大学のマーク・マクラクラン教授の共同研究グループは,片手型のアミノ酸を一切含まないペプチドを用いて,一方向巻きのα-ヘリックス(※1)構造を構築することに,世界で初めて成功しました。
ペプチドやタンパク質が折り畳まれて形成する構造モチーフの代表例に,α-ヘリックスと呼ばれるらせん構造が挙げられます。天然のペプチドやタンパク質は,左手型のアミノ酸から構成されていて,結果として右巻きのα-ヘリックス構造をとります。しかし,片手型のアミノ酸を含まないα-ヘリックスは,右巻きと左巻きが溶液中で1秒間に数千から数万回の速さで互いに入れ替わり,両者が同量の混合物となります。そのため,このようなペプチドから右巻きと左巻きのα-ヘリックスを分離して取り出すことは不可能と考えられてきました。本研究では,このようなα-ヘリックスの側面を「ステープル分子」で二重に「ホチキス留め」することで,この反転を約1兆倍も遅くして事実上止めることに成功しました。この「ホチキス留め」の方法により,片手型のアミノ酸を一切含まないペプチドの一方向巻きのα-ヘリックスを取り出すことにも成功しました。
これらの知見は将来,安定なα-ヘリックス構造が必要なペプチド医薬品の開発や,α-ヘリックス構造の本質のより深い理解に活用されることが期待されます。
本研究成果は,2023年10月26日(英国時間)に英国科学誌『Nature Communications』のオンライン版に掲載されました。
研究の背景
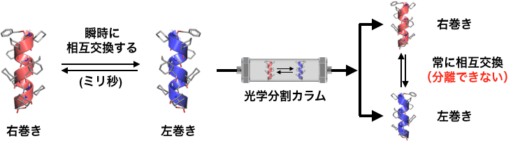
アミノ酸がいくつもつながってできるペプチドやタンパク質・酵素は,特定の構造に折り畳まれることで機能を発現します。その折り畳み構造の代表例に「α-ヘリックス」があり,これは約3.6個のアミノ酸で一巻きするらせん構造を持ちます(図1)。天然のペプチドやタンパク質は,左手型(L)のアミノ酸から構成されていて,結果として右巻きのα-ヘリックス構造をとります。一方,左手型を鏡に映した立体構造を持つ非天然の右手型(D)からなるペプチドは,左巻きのらせん構造を持ちます。このような鏡像の関係(LとD,右巻きと左巻きなど)にあって互いに重ね合わせることのできない分子をキラルな分子と呼びます(図1A)。一方,自身の鏡像と重ね合わせることのできる分子をアキラルな分子と呼びます(図1B)。α-ヘリックス構造のらせんの巻き方向は,このキラルな片手型のアミノ酸によって決まります。したがって,片手型(LまたはD)のアミノ酸を含まないペプチドのα-ヘリックスは,右巻きと左巻きの偏りがなく同量となります。実際には,このようならせんペプチドは,右巻きと左巻きに固定されたらせんが同量あるのではなく,両者が溶液中で常に互いに入れ替わっています。その速さは1秒間に数千回にも達します。(図2)。つまり,仮に右巻きと左巻きのどちらか一方を取り出すことができても,瞬時に右巻きと左巻きの混合物に戻ります。このため,このようなα-ヘリックスの右巻きと左巻きを分離することは不可能でした(図2)。
本研究では,このらせんペプチドの右巻きと左巻きの間の入れ替わりをほぼ完全に止める方法として,二重の「分子のホチキス留め」が効果的であることを見出しました。これにより,これまで作るのが不可能と思われていた片手型のアミノ酸を含まない一方向巻きのα-ヘリックス構造を作ることに成功しました。
研究成果の概要
本研究グループは,ホチキスの針(ステープル)のような棒状分子(ステープル分子)によって,らせん構造の側面を「ホチキス留め」(ステープリング)することで,前述のらせん反転を防ぐ(遅くする)ことができると予想しました(図3A)。そこで,α-ヘリックス構造を形成しやすい非天然のアキラルなアミノ酸を基本骨格として,ステープリングの基点となる部位を,適切な位置に導入したペプチド分子を新たに設計・合成しました。このペプチド分子に固い棒状のビフェニル構造を含む「ステープル分子」を反応させて,α-ヘリックス構造を一重あるいは二重にステープリングしました(図3B)。
次に,ステープリングしたことで右巻きと左巻きの入れ替わりがどの程度抑えられるかを調べるために,これらのペプチド鎖の末端には片手型のアミノ酸(L-バリン)を導入しました。これにより,酸や塩基を加えたときに,らせんの巻き方向を可逆的に入れ替えることができ(図3C),その変化の速さを計測することでらせんの反転速度を見積もることができます。
実際,一重のステープリングを施したらせんペプチドは,ステープリングなしのペプチドに比べ約100万倍も反転速度が遅くなりました。反転の時間尺度はミリ秒から数分程度まで遅くなります。さらに,二重のステープリングを施した場合では,ステープリングなしのペプチドに比べて,約1兆倍も反転速度が遅くなることを明らかにしました(図4A)。このときの時間尺度は数年に相当します。したがって,二重のステープリングにより,らせん反転をほぼ静止できたと言えます。
右巻きと左巻きのα-ヘリックスが入れ替わらないのであれば,両者を分離することもできるはずです。そこで,アキラルな構成単位のみからできたペプチドに二重のステープリングを施してα-ヘリックスを合成し,その右巻きと左巻きを分離できるかを調べてみました。その結果,光学分割カラム(※2)を使うことで両者を分離することに成功しました。元の同量の混合物に戻るのには数年以上かかると見積もられ,右巻きと左巻きの入れ替わりは事実上止まっていると言えます(図4B)。これがまさに,片手型のアミノ酸を一切含まないペプチドから作った一方向巻きのα-ヘリックス構造です。このようなα-ヘリックスを作るのはこれまで不可能と考えられていましたが,ステープル分子により「分子のホチキス留め」(ステープリング)をすることでこれを実現できることを実証しました。
今後の展開
本研究成果は,安定なα-ヘリックス構造を形成するペプチドを設計する際の重要な指針になるだけでなく,α-ヘリックス構造が必要なペプチド医薬品の開発,α-ヘリックス構造の本質のより深い理解に活用されることが期待されます。
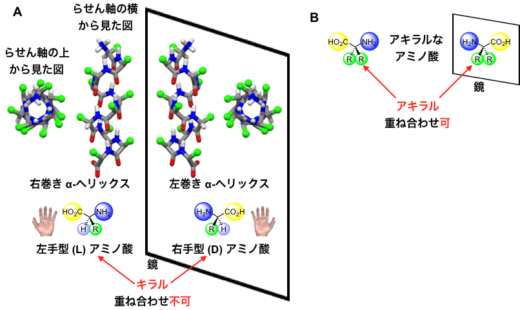
図1. A:左手型(L)アミノ酸からなる右巻きα-ヘリックスと,その鏡像の関係にある右手型(D)アミノ酸からなる左巻きα-ヘリックス。左手型(L)とその鏡像の右手型(D)のアミノ酸は重ね合わせることができないので,キラルなアミノ酸である。B:鏡に映した自身と重ね合わせることができる片手型を持たないアキラルなアミノ酸。
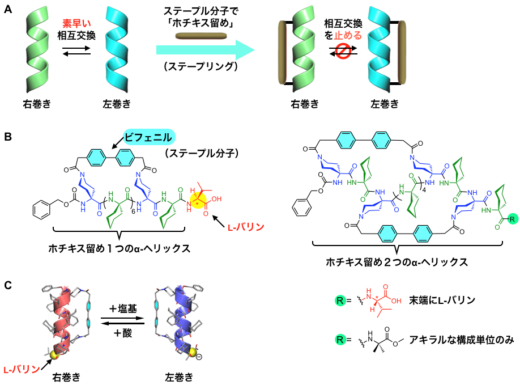
図3. A:ステープル分子によるα-ヘリックスの「ホチキス留め」。これによりらせんの反転を遅くして止めることを目指す。B:「ホチキス留め」を1つおよび2つ導入したα-ヘリックスの分子構造。ステープル分子としてビフェニル骨格を用いた。C:末端にL-バリンを導入したα-ヘリックスの右巻きと左巻きの変換。「ホチキス留め」を1つ持つα-ヘリックスの場合,酸と塩基の添加により,数分の時間尺度で可逆的に右巻きと左巻きが入れ替わる。
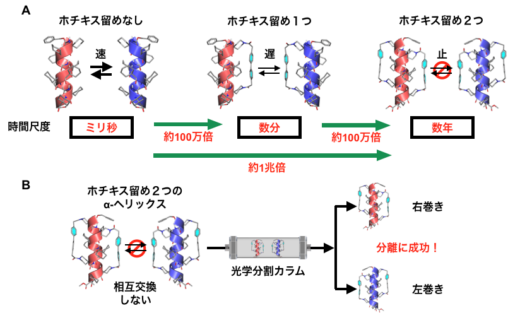
図4. A:「ホチキス留め」の数とらせん反転速度の関係。「ホチキス留め」1つにつき相互交換の時間尺度が1,000,000倍長くなる。B:α-ヘリックスに「ホチキス留め」を2つ導入すると,右巻きと左巻きの相互交換が事実上起こらなくなる。その結果,光学分割カラムを用いて右巻きと左巻きを分離でき,片手型のアミノ酸を持たないペプチドの一方向巻きのα-ヘリックスを初めて取り出すことに成功した。
用語解説
掲載論文情報
- 論文タイトル
- Stapling strategy for slowing helicity interconversion of α-helical peptides and isolating chiral auxiliary-free one-handed forms (ステープリング戦略によるα-ヘリカルペプチドのらせん反転の抑制とキラル補助剤を含まない一方向巻きのα-ヘリカルペプチドの単離)
- 著者
- Naoki Ousaka,Mark J. MacLachlan,Shigehisa Akine (逢坂直樹,マーク・マクラクラン,秋根茂久)
- 掲載誌
- Nature Communications
- 掲載日
- 2023.10.26
- DOI
- 10.1038/s41467-023-42493-y
- URL
- https://doi.org/10.1038/s41467-023-42493-y