まるで連なったソーセージ?COVID-19重症化因子ORF6タンパク質による凝集体の動態観察に成功!

The Journal of Physical Chemistry Lettersの中表紙に選出されました!
金沢大学大学院新学術創成研究科ナノ生命科学専攻/ナノ精密医学・理工学卓越大学院プログラム履修生の西出梧朗(博士後期課程2年),金沢大学ナノ生命科学研究所のキイシヤン・リン特任助教,安藤敏夫特任教授,千葉大学大学院薬学研究院の西田紀貴教授,金沢大学ナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らの共同研究グループは,新型コロナウイルス(SARS-CoV-2)タンパク質の一つであるOpen Reading Frame 6(ORF6)(※1)が形成した,円形や線状の凝集体の動態観察に初めて成功しました。
SARS-CoV-2は驚異的な感染力を備え,重篤な肺炎を起こすウイルスであり,その感染症COVID-19は2019年以来社会活動に甚大な影響を及ぼしています。ORF6は,SARS-CoV-2が宿主細胞へ感染後に発現し,核膜孔(※2)を介した宿主の正常な生体分子輸送を阻害するだけでなく,最も強力なインターフェロン(IFN)(※3)アンタゴニストとしてIFN経路活性化も阻害するため,COVID-19重症化因子の一つであることが分かっています。しかし,数nm(10-9 m)の小さなORF6の挙動すなわち分子動態情報が不足しているため,創薬には至っていません。
本研究では,サイズ排除クロマトグラフィー法(SEC法)と核磁気共鳴分光測定法(NMR法)(※4)を用いて,ORF6が自己集合してオリゴマー(※5)化し,一部の領域は柔軟な構造をとることを発見しました。さらに,高速原子間力顕微鏡(高速AFM)(※6)を用いて,ORF6はオリゴマーをもとに,疎水性相互作用を分子間力とした円形や線状の凝集体を形成することを観察しました。また,肺がん細胞におけるORF6の蓄積はInterleukin-6(IL-6)(※7)発現を誘導することから,COVID-19患者の肺病理やアミロイド関連の合併症発症に寄与している可能性を見いだしました。
これらの知見は将来,COVID-19やその重症化における新たな治療法の確立に貢献することが期待されます。
本研究成果は,2023 年 9 月14日(米国東部時間)に米国科学誌『The Journal of Physical Chemistry Letters』のオンライン版に掲載されました。
研究の背景
ORF6は,SARS-CoV-2のアクセサリータンパク質の一つです。SARS-CoV-2は感染後,宿主細胞の系を利用してORF6を発現させ,自身の生存に有利になるように宿主環境を再構成しています。たとえば,mRNA輸送タンパク質であるRae1やNup98を細胞質に停滞させたり,核からのmRNAの輸出を妨害したりすることを,私たちはこれまでの研究で発見しています。さらに,ORF6はCOVID-19の重症度と関連していることや,宿主の核輸送をハイジャックして,IFN-1のシグナル伝達を強力に抑制することが報告されています(Xia H. et al. Cell Rep. 2020)。COVID-19におけるORF6の役割を明らかにすることは,COVID-19の新たな治療法につながる重要な課題です。
また,全長61アミノ酸残基から成るORF6は,約7 kDaほど(数nm)のとても小さなタンパク質であるため,X線結晶構造解析などの従来のナノイメージングを行うことは困難です。そのため,宿主の核輸送をハイジャックするためのORF6の構造特性や分子動態については不明でした。
研究成果の概要
本研究では,全長ORF6タンパク質をナノスケールで観察し,構造動態を明らかにすることを目的としました。結果として,ORF6は細胞内においてアミロイド線維を形成することで,COVID-19の肺病理やアミロイド関連の合併症発症に関連している可能性を見いだしました。
まずSEC法による解析からORF6が巨大なオリゴマーを形成していること,NMR法による解析から,自己集合したORF6は無秩序で特定の構造を持たない柔軟な領域を含むことが示唆されました。実際に,高速AFMによる直接観察では,ORF6の多くがオリゴマーとして存在していることが分かりました。さらにORF6オリゴマーは,連なったソーセージのように,一つひとつがつながった円形や線状のプロトフィブリル,間の境目がなく成熟したアミロイド線維を形成していました(図1)。このオリゴマー間に働く分子間力を調べるため,脂肪族アルコールなどの化合物を添加したところ,疎水性相互作用によってオリゴマーは連なっていることが明らかとなりました(図2)。また,細胞実験により,細胞外部に存在したORF6は肺がん細胞に取り込まれ,細胞質の核膜近傍に集積することが分かりました。その結果,IL-6の発現が促進されました。
このことから,細胞内におけるORF6の蓄積は,肺の炎症が誘発され,COVID-19特有の肺機能の低下に寄与するだけでなく,神経変性疾患などのアミロイド関連の合併症も引き起こすことが示唆されました(図3)。
今後の展開
本研究成果により,ORF6を標的としたCOVID-19における新たな治療法や創薬につながることが期待されます。
参考図
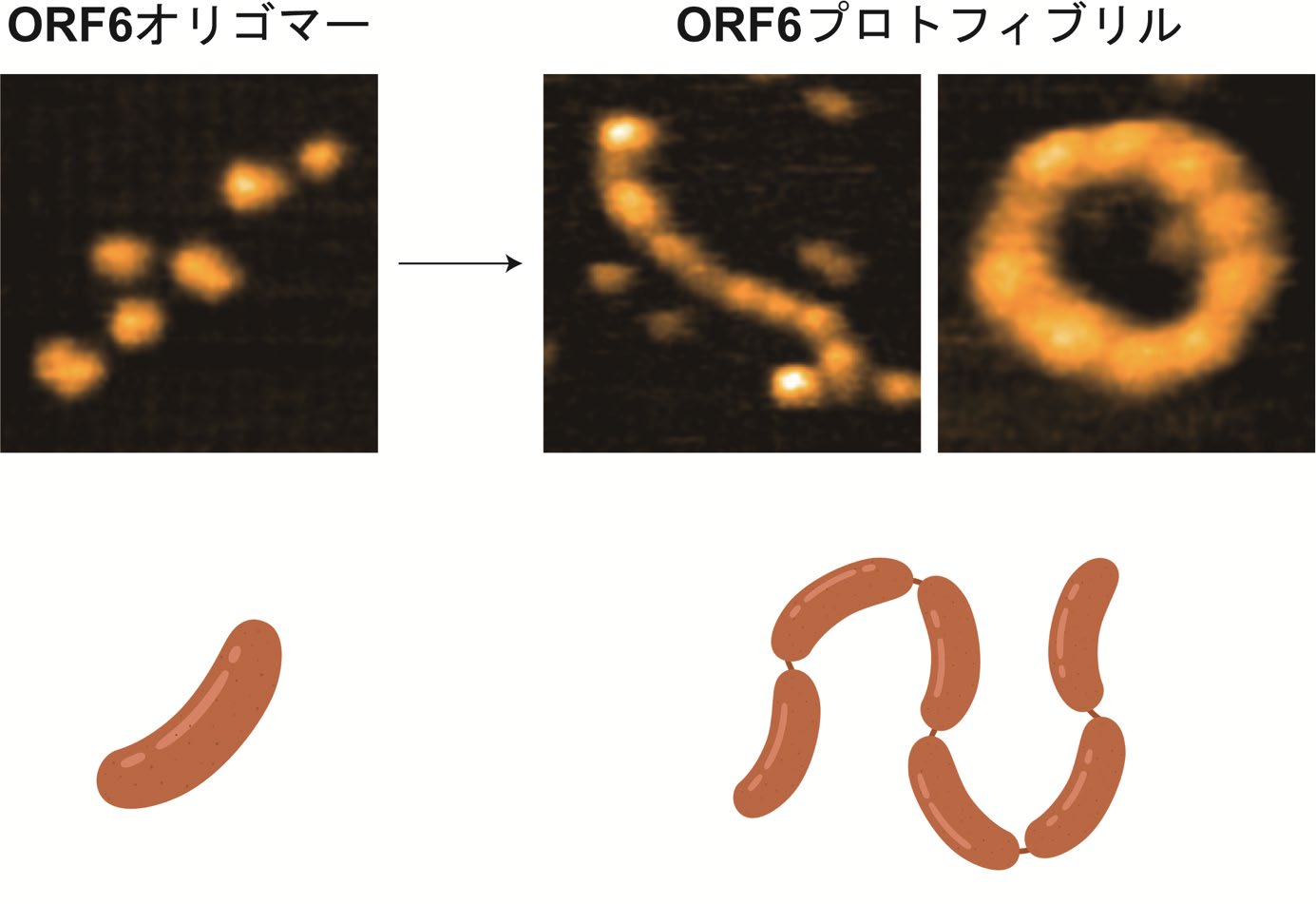
図1: ORF6の凝集体
高速AFMによる直接観察から,ORF6はオリゴマーやプロトフィブリル,アミロイド線維といった凝集体を形成していることが分かりました。
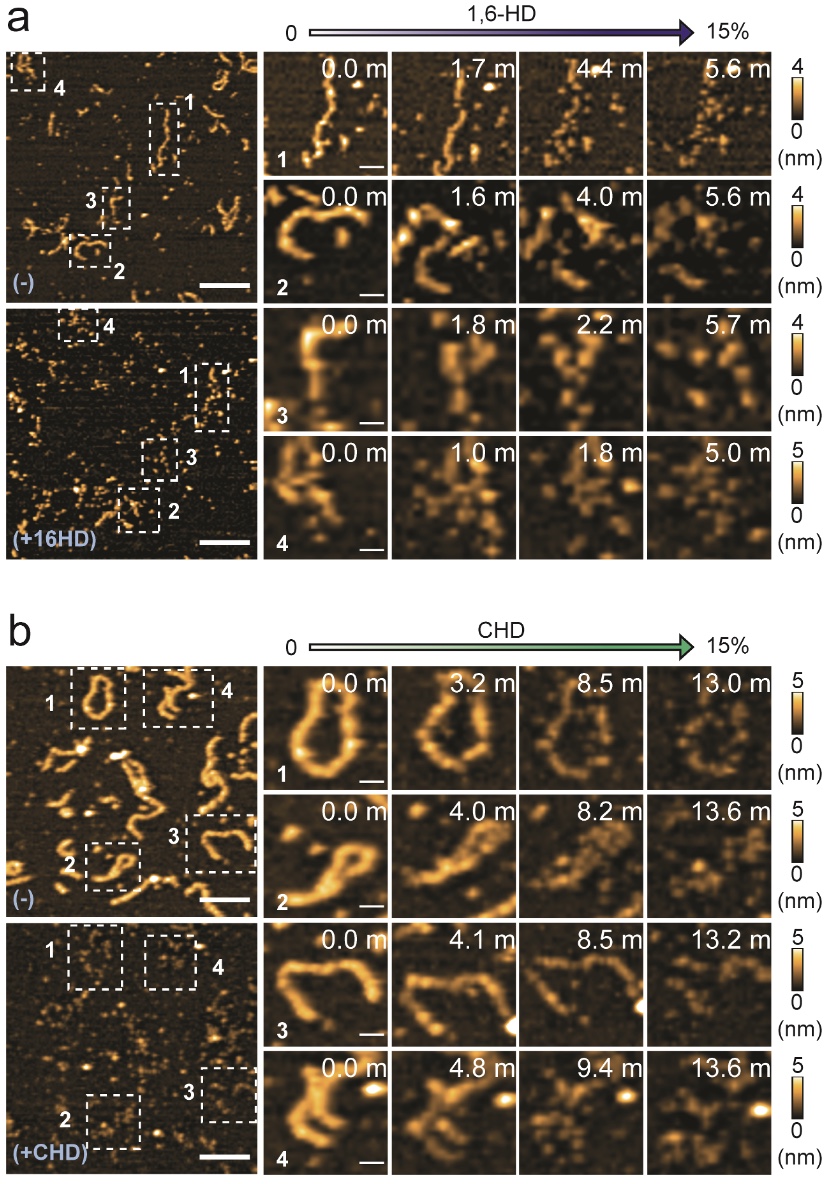
図2: ORF6凝集体の解離・拡散
特定の脂肪族アルコール((a) 1,6-ヘキサンジオール(1,6-HD),(b) trans-1,2-シクロヘキサンジアミン(CHD))は,疎水性相互作用を阻害します。これら脂肪族アルコールをORF6凝集体に加えると,疎水性相互作用に影響し,凝集体が解離・拡散する様子が高速AFMにより観察されました(スケールバー: a (˗) & (1,6-HD), 200 nm; a (1), 56 nm; a (2), 36 nm; a (3), 24 nm; a (4), 30 nm, b (˗) & (CHD), 200 nm; b (1,2), 44 nm; b (3), 48 nm, b (4), 40 nm)。
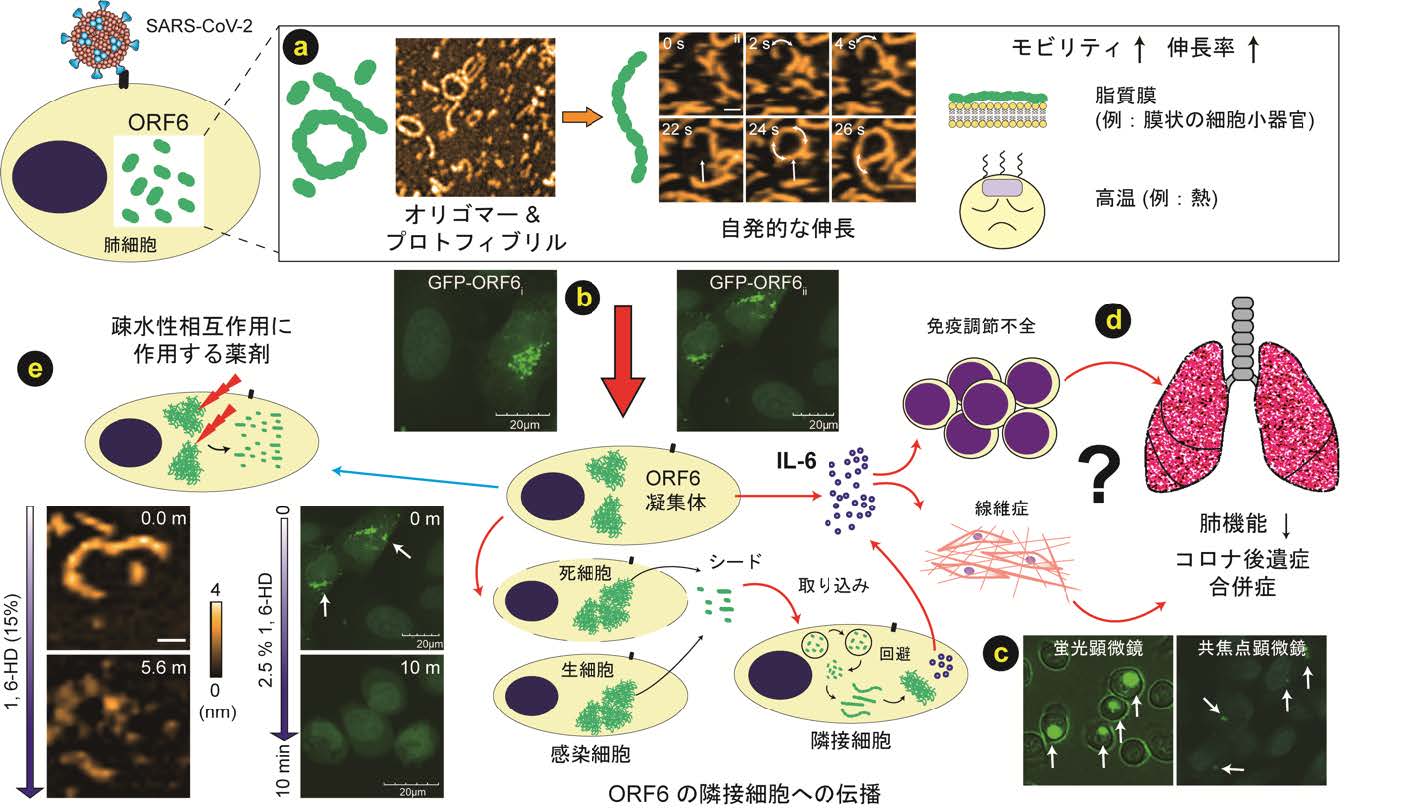
図3: ORF6によるCOVID-19への影響および合併症の可能性
(a, b) SARS-CoV-2 ORF6タンパク質は自己集合を起こし,感染細胞内で凝集体を形成します。 (c) 感染細胞(生細胞または死細胞)から放出された外因性ORF6タンパク質は隣接する細胞内部に取り込まれ,凝集する可能性があります。(d) ORF6凝集体の蓄積は肺細胞におけるIL-6発現を誘導します。肺上皮由来のIL-6は,COVID-19患者の肺病理に関連している可能性があります。(e) ORF6凝集体の疎水性相互作用を阻害する創薬が求められます。
用語解説
掲載論文情報
- 論文タイトル
- Nanoscopic Elucidation of Spontaneous Self-Assembly of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Open Reading Frame 6 (ORF6) Protein
- 著者
- Goro Nishide, Keesiang Lim, Maiki Tamura, Akiko Kobayashi, Qingci Zhao, Masaharu Hazawa, Toshio Ando, Noritaka Nishida, Richard W. Wong
- 掲載誌
- The Journal of Physical Chemistry Letters
- 掲載日
- 2023.09.14
- DOI
- 10.1021/acs.jpclett.3c01440
- URL
- https://doi.org/10.1021/acs.jpclett.3c01440

