高機能バイオ医薬候補創成に成功!
金沢大学ナノ生命科学研究所/がん進展制御研究所の佐藤拓輝特任助教・松本邦夫教授,東京大学大学院理学系研究科の菅裕明教授らの共同研究グループは,新たなタンパク質工学手法を用いて,細胞増殖因子の一つ肝細胞増殖因子(HGF)と同等の活性をもち,HGFよりも生体内での安定性に優れた新規タンパク質『U-body』を創成することに成功しました。
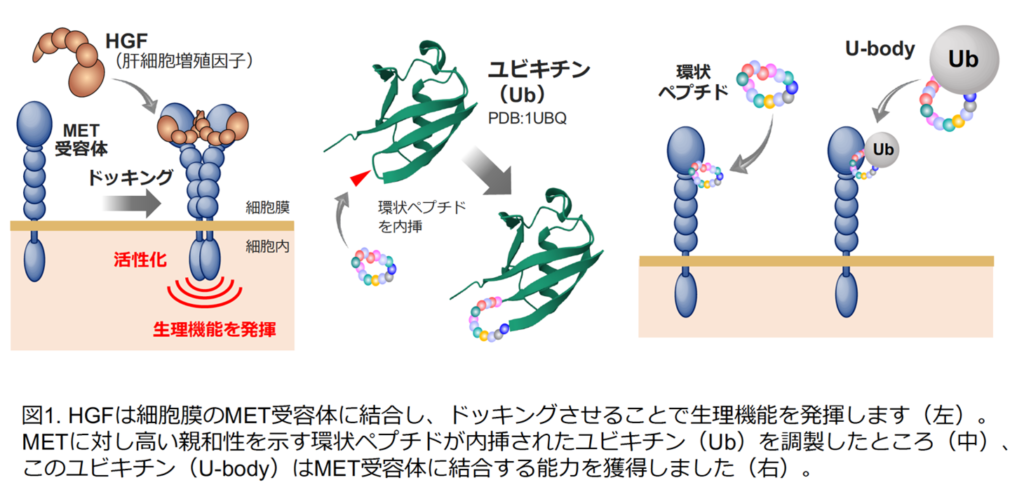
細胞増殖因子と呼ばれる生理活性タンパク質は,低分子化合物では置き換えられないような高い生理活性を示し,いくつかの細胞増殖因子は組織の再生を促す医薬として利用されていますが,一般に分解されやすい性質を持ちます。そのため,医薬品として広く疾患治療に応用するためには,より化学的に安定で,同時に細胞増殖因子の活性を合わせ持つ代替分子の創成が望まれます。本研究グループは,肝細胞増殖因子(HGF)(※1)がMET受容体(※2)同士をドッキングさせることに着目し,MET受容体同士をドッキングさせる新しい分子を作ることを考えました。そのために,MET受容体に結合する十数個のアミノ酸がつながった環状ペプチドの配列を,比較的安定で小さなタンパク質であるユビキチン(※3)分子内に挿入(内挿)し,それを連結した分子『U-body』を創成しました。その結果,この『U-body』はMET受容体同士のドッキングを引き起こし,受容体を活性化しました。すなわち,安定な性質をもちながら,同時に細胞増殖因子の活性を持つ「人工HGF」の創成です。
HGFは有用な治療薬のない脊髄損傷などに対する治療薬になることが期待されています。今回の研究成果では,新しい技術によって安定性に優れた人工細胞増殖因子を創出できることが明らかにされました。この技術は,将来バイオ医薬品の新たな創薬開発プラットフォームになる可能性があり,再生医療分野への応用が期待されます。
本研究成果は,2023年7月14日にドイツ化学会誌『Angewandte Chemie International Edition』のオンライン版に掲載されました。
研究の背景
細胞増殖因子やサイトカインなどの生体内分子は,低分子化合物では代替できないような顕著な生理機能を示すため,それらのいくつかはバイオ医薬(※4)と利用されています。ただし,これらの分子は,強い生理作用が過剰にならないため,比較的速やかに分解される性質があります。そのため,医薬品としての化学特性に乏しく,さまざまな疾患治療への応用は限定的でした。より多くの細胞増殖因子やサイトカインがより多くの疾患や難病の治療に応用するためには,細胞増殖因子の活性を持ちながら,同時に化学的に安定な性質を合わせもつ新しい代替分子を創成することが必要でした。
これまでに,菅教授らのグループは,標的タンパク質に対してきわめて高い特異性と親和性を持つ環状ペプチドを高効率で取得する探索システムであるRaPID法(※5)を開発しています。また,RaPID法で同定した環状ペプチドの配列を,投げ縄(lasso)のごとく任意のタンパク質の分子内に挿入(移植/graft)することで,いわばペプチドの乗り物になるタンパク質の構造・生理機能を維持したまま,環状ペプチドの結合親和性を付与できる技術Lasso graft法(※6)を開発しました。これにより,多機能な人工タンパク質をデザイン・調製することが可能となっています。
研究成果の概要
研究グループは,肝細胞増殖因子(HGF)がMET受容体同士をドッキングさせることでMET受容体を活性化することに着目しました。戦略として,MET受容体に結合する環状ペプチドを取得し,その環状ペプチドを小さなタンパク質内に埋め込み,これを連結すればMET受容体がドッキングすると考えられました(図1,図2)。環状ペプチドを埋め込む乗り物となるタンパク質としてユビキチンが使用されました。その理由として,ユビキチンは,76個のアミノ酸からなり,生体内に広く存在する小さなタンパク質で,体内で安定な性質を持っているからです。そこで,まずユビキチンの分子内へペプチド配列を挿入し,MET受容体に高い結合親和性を持つ組換えユビキチン分子(U-body)を作製しました(図1)。さらに,U-body同士が連結された分子を調製したところ,それらはMET受容体同士をドッキングさせ, MET受容体を活性化することを明らかにしました(図2)。

ユビキチンは分子サイズが小さいことから,比較的安価に製造することが可能です。本研究では,ユビキチンに環状ペプチドの配列を挿入し,連結することで,安価で安定な人工の増殖因子(HGF)を作製することに成功しました。
今後の展開
『U-body』は新たなバイオ医薬として疾患治療に利用される可能性があります。また,特定の分子に対して高い親和性を持つ分子は,がんの診断分野に応用できる可能性があります。本研究ではHGFおよびMET受容体を分子例として実施されましたが,今回,研究に用いられた手法は,より安価で高機能な人工細胞増殖因子を作製するための普遍性の高いプラットフォームとして,さまざまな疾患に対する創薬開発研究に応用されることが期待されます。
用語解説
掲載論文情報
- 論文タイトル
- MET-Activating Ubiquitin Multimers (MET受容体を活性化する多量体ユビキチンの開発)
- 著者
- Naoya Kawakami, Hiroki Sato, Naohiro Terasaka, Kunio Matsumoto, and Hiroaki Suga (河上直也§,佐藤拓輝§,寺坂尚紘,松本邦夫*,菅裕明*)(§equal contribution; *責任著者)
- 掲載誌
- Angewandte Chemie International Divsion
- 掲載日
- 2023.07.14
- DOI
- 10.1002/anie.202307157
- URL
- https://onlinelibrary.wiley.com/doi/10.1002/anie.202307157

