生細胞の表面構造をナノスケールで直接可視化
~エクソソームなど細胞間コミュニケーションの理解に貢献~
本研究のポイント
- 生きた細胞のダイナミックな構造変化をナノスケールで可視化。
- イメージングの再現性を大幅に向上させるプローブ作製方法を確立。
- 細胞外物質の取り込み過程を可視化。
- 細胞が放出したエクソソームを直接可視化。
- 細胞間コミュニケーションの理解への貢献に期待。
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/名古屋大学大学院工学研究科の高橋康史教授,WPI-NanoLSIの華山力成教授,福間剛士教授,および海外主任研究者(PI)で英国・インペリアル・カレッジ・ロンドンのユリ・コルチェフ教授らの共同研究グループは,生細胞表面の構造をナノスケールのレベルで可視化する技術を確立し,細胞外物質の取り込み過程や,細胞間コミュニケーションに関与するエクソソーム(※1)の可視化に成功しました。
ウィルスの細胞内への侵入や,細胞内外との物質のやり取りを観察するためには,現状の顕微鏡技術の空間分解能では不十分です。そのため,超解像度顕微鏡(※2)など高分解能化が進められていますが,依然として空間分解能に課題を抱えています。細胞を生きたまま直接可視化するライブセルイメージングは,細胞のダイナミックな動きを理解することのできる方法です。走査型イオンコンダクタンス顕微鏡(SICM)(※3)は,細胞のナノ構造を侵襲することなく生きた状態でライブイメージングを行うことができます。しかしながら,SICMの解像度向上に不可欠なガラスナノピペット(※4)の微細化が困難なため,これまではその高度な技術を持つ限られた研究グループのみが超解像度のイメージングを達成してきました。本研究では,このような細胞表面のナノスケールの構造変化を再現性良く観察するため,キーとなる微細なガラスナノピペットの作製法を確立しました。さらに,高解像度SICMにより,細胞外の物質を取り込む過程の1つであるエンドサイトーシスを連続的に可視化することや,細胞外へ放出されるエクソソームの動きを捉えることに成功しました。
本研究成果は,2023年8月20日付(米国東部時間)でアメリカ化学雑誌「Analytical Chemistry」のオンライン版に掲載されました。
研究の背景
細胞の構造は,時々刻々と変化を続けており,細胞の遊走,伸長,浸潤,増殖など構造変化が密接に関係しています。それ以外にも細胞外の物質の取り込みや,他の細胞とコミュニケーションを取るため,生体分子をやり取りしています。ライブセルイメージングは,このような細胞の構造変化を,細胞を生きたまま直接可視化することで,細胞の構造変化と機能の関係を理解可能です。しかし,ウィルスの細胞内への侵入や,細胞内外との物質のやり取りを観察するためには,現状の顕微鏡技術の空間分解能では不十分です。そのため,超解像度顕微鏡など高分解能化が進められていますが,依然として,空間分解能に課題を抱えています。
走査型イオンコンダクタンス顕微鏡(SICM)は,細胞のナノ構造を生きた状態で可視化することができるため,細胞のダイナミックな変化を直接可視化することができます。SICMでは,ガラスナノピペットを試料に近接させた際に生じるイオン電流の変化を利用して,試料の高さ情報を取得しながら,ガラスナノピペットを走査することで,試料の表面形状を取得します(図1)。しかし,SICMの解像度向上に不可欠なガラスナノピペットの微細化が困難なため,これまで,限られた研究グループのみが超解像度のイメージングを達成してきました。

図1.走査型イオンコンダクタンス顕微鏡(SICM)の計測原理図
ナノピペットと試料の存在する溶液に配置した2本のAg/AgCl電極の間に一定の電圧を加え,その際に生じるイオン流に起因したイオン電流を利用して,ナノピペットと試料との距離を制御し,高さ情報を取得します。XY方向に走査しながらこの計測を行うことで,形状イメージを取得することができます。
研究成果の概要
本研究では,このような細胞表面のナノスケールの構造変化を高い再現性で観察するため,最重要要素である微細なガラスナノピペットの作製法の開発に取り組みました。ナノピペットを作製する際には,CO2レーザープラー(※5)でガラスキャピラリー(毛細管)を加熱しながら伸長します。この過程で,ガラスキャピラリーが細くなっていき,ガラスの最も細くなっている部分が破断して,ガラスキャピラリーが2つに分かれることで,ガラスナノピペットが作製されます。そのため,肉厚のガラス管,つまりガラス管の外側/内側の比が大きなものほど,細いガラスナノピペットを作成することができます。しかし,市販されているものでは選択肢が限られます。そこで,事前にCO2レーザープラーにより,ガラスキャピラリーの一部を局所的に加熱して,内外径比を調節することで,微細なナノピペットの作製を行いました。図2にこの事前加熱の条件検討と作製されるナノピペット先端部の電子顕微鏡(※6)写真とIV特性(※7)を示します。CO2レーザープラーをより高い温度の加熱条件にすることで,より肉厚のガラスキャピラリーへと変形していることがわかります。また,このガラスの内外径比を調整したキャピラリーを伸長することで,半径が15 ナノメートル以下のガラスナノピペットを作製することができました。

図2.ガラスナノピペットの内外径比と微細なナノピペットの作製法
(a)ガラスキャピラリーの事前加熱後と (b)第一伸長プロセス後の光学顕微鏡写真,作製されたナノピペットの (c)光学顕微鏡と (d)電子顕微鏡写真,(e)PBS(-)溶液中でのIV特性
このようにして作製したガラスナノピペットを用いて,細胞表面に形成されるくぼみ(クラスリン被覆ピット)(※8)の観察を行いました(図3(a))。細胞表面の無数に存在する微絨毛(びじゅうもう)とともに,点状にこのくぼみは,細胞外のものを細胞内に取り込む際に形成される直径が120 ナノメートルほどのもので,従来の光学顕微鏡では可視化することができません。しかし,このようなナノスケールの構造はSICMによって可視化することが可能です。SICMを用いて生細胞の観察および計測を行うと,この細胞表面に形成されているくぼみを介して実際に細胞外物質の取り込み過程を可視化することができました(図3(b))。さらに,この細胞外物質の取り込み過程において,細胞膜がくぼみ構造に覆いかぶさる様子をリアルタイムで可視化することができました。

図3.SICMによる細胞表面形状の超解像度イメージング
(a)SICMによるHeLa細胞の超解像度形状イメージング,イメージサイズ 20 × 20 平方マイクロメートル
(b)エンドサイトーシスのタイムラプス計測(36秒/フレーム),イメージサイズ 2.5 × 2.5 平方マイクロメートル
続いて,細胞外物質の取り込みだけでなく,細胞が放出するエクソソームに関しても,SICMによる可視化を行いました。エクソソームは,距離の離れた細胞との間でのコミュニケーションに利用されるカプセル状の構造物で,このカプセル内に遺伝子情報などを含んでいます。この大きさは,200 ナノメートル以下であり,光学顕微鏡では可視化できません。細胞から放出されるエクソソームは溶液中を漂いながら他の細胞に取り込まれますが,SICMでのイメージングのために,放出されたエクソソームを基板が補捉できるように工夫を施しました。この状態で,まず,共焦点顕微鏡を使ってイメージングを行うと,細胞の一部の領域からエクソソームが放出されているのがわかります。しかし,光学顕微鏡の分解能の限界から個々のエクソソームを識別することはできません。そこで,SICMを用いてイメージングを行うと,個々のエクソソームを鮮明に可視化することができました。さらに,得られた形状情報を横断的に解析したクロスセクションから高さが180 ナノメートルほどであることが確認できました。
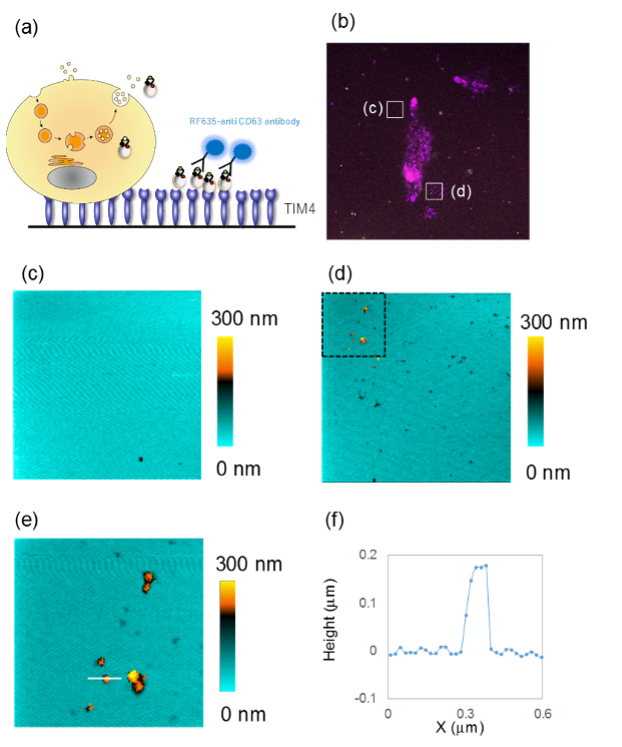
図4.SICMによる細胞外小胞(エクソソーム)のイメージング
(a)細胞から放出されたエクソソームの蛍光イメージングの概要,(b)細胞と放出されたエクソソームの共焦点顕微鏡イメージ,(c)共焦点顕微鏡イメージにおいてエクソソームがほとんどみられなかった領域のSICMイメージ,(d)エクソソームが多く確認された領域のSICMイメージ,(e) (d)の破線四角部分の拡大SICMイメージ,(f) (e)のクロスセクション(白線箇所)
イメージサイズ:(c, d) 10 × 9.8 平方マイクロメートル,(e) 3.0 × 3.0 平方マイクロメートル
今後の展開
SICMは,光学顕微鏡の解像度では可視化できない細胞表面の構造変化を,細胞が生きた状態のまま観察することが可能な顕微鏡です。本研究では,このSICMで使用するガラスナノピペットの微細化手法を確立し,半径15 ナノメートル以下のガラスナノピペットを作製できるようになりました。このことで,細胞外物質の取り込みの過程や,エクソソームの放出が活発に起こる領域と放出されるエクソソームが個々で識別可能となりました。
このように,これまで困難であった微細なガラスナノピペット作製法を確立できたことは,ライブセルの超解像度イメージングの高度な技術の共有を促進します。今後は,ウィルスの取り込み機構の解明や,細胞間コミュニケーションの理解が進み,さらに,さまざまな疾病の発症メカニズムの解明や新たな治療法・治療薬の開発に繋がることが期待できます。
用語解説
掲載論文情報
- 論文タイトル
- Nanopipette Fabrication Guidelines for SICM Nanoscale Imaging(走査型イオンコンダクタンス顕微鏡を用いたナノスケールのイメージングのためのガラスナノピペットの作製方法のガイドライン)
- 著者
- Yasufumi Takahashi, Yuya Sasaki, Takeshi Yoshida, Kota Honda, Yuanshu Zhou, Takafumi Miyamoto, Tomoko Motoo, Hiroki Higashi, Andrew Shevchuk, Yuri Korchev, Hiroki Ida, Rikinari Hanayama, and Takeshi Fukuma(髙橋康史,佐々木祐哉,吉田孟史,本田航大,周縁殊,宮本貴史,元尾朋子,東宏樹,アンドリュー・シェブチェック,ユリ・コルチェフ,井田大貴,華山力成,福間剛士)
- 掲載誌
- Analytical Chemistry
- 掲載日
- 2023.08.20
- DOI
- 10.1021/acs.analchem.3c01010
- URL
- https://doi.org/10.1021/acs.analchem.3c01010

