記憶の形成・忘却を司るタンパク質の “はたらく姿”をナノスケールで撮影!
本研究のポイント
- 脳の神経細胞に豊富に存在し,記憶形成や忘却を担うタンパク質(CaMKII)のはたらく姿をナノスケールで詳細に明らかにした。
- ヒドラや線虫のCaMKIIと比較して,ラット由来のCaMKIIだけが自己リン酸化による触媒ドメイン集合体を形成することが分かった。
- ヒドラや線虫のCaMKIIと比較して,ラット由来の CaMKIIは脱リン酸化酵素により強い耐性を持っていることが分かった。
金沢大学ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授,自然科学研究機構生理学研究所の村越秀治准教授の共同研究グループは,脳内の記憶形成や忘却に関わる酵素“カルシウム/カルモジュリン依存性キナーゼII(CaMKII)”の入力依存的な構造変化(活性化)を,高速原子間力顕微鏡(高速AFM)(※1)を用いて,ナノメートルスケールで可視化することに成功しました。種依存的なCaMKII構造の違いや薬剤に対する応答メカニズムは,将来,記憶や学習,認知といった脳機能を分子レベルで理解することにつながり,アルツハイマー病をはじめとするさまざまな精神・神経疾患の臨床応用(治療薬)に繋がることが期待されます。
本研究成果は,2023年6月30日14時(米国東部時間)に国際科学誌『Science Advances』オンライン版に掲載されました。
研究の背景
私達人間にとって,過去の経験や学習の記憶は,日々の生活を過ごす上で必要なものであり,個性やアイデンティティの形成にも重要な役割を果たしています。記憶は,脳内の大脳皮質や海馬の神経細胞のネットワークによって保持されています。特に,神経細胞と神経細胞をつなぎ,情報を伝える部位であるシナプスの変化が,記憶や学習,またこれらに関係した神経疾患と深い関係があることが明らかになってきています。
例えば,シナプスの体積や各種受容体が増えることで,長期的に情報伝達効率が向上することが分かっています。このような伝達効率の変化は,長期増強(long-term potentiation: LTP)と呼ばれ,記憶形成や維持に関与すると考えられています。一方で,シナプス体積や受容体の減少は長期抑制(long-term depression: LTD)と呼ばれ,記憶の忘却に関与すると考えられています。
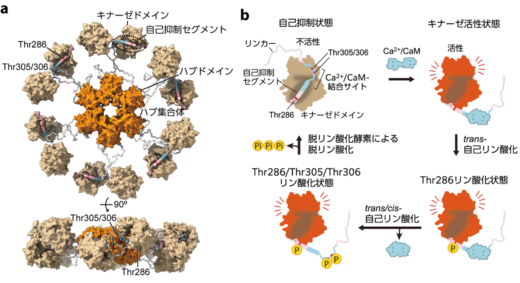
このようなLTPやLTDをはじめとしたシナプスの可塑性には,カルシウム/カルモジュリン依存性キナーゼII(CaMKII)とよばれる酵素が重要な役割を果たすことが知られています(図1)。CaMKIIは12量体のセリン・スレオニンキナーゼであり,100万年以上にわたって,ヒドラや線虫を含む後生動物間で高度に保存されています。ラットをはじめとした哺乳類では,CaMKIIは大脳皮質や海馬の神経細胞内に豊富(全タンパク量の数パーセントを占める)に存在しています。
LTPやLTDが起こる際には,シナプス内にカルシウムイオン(Ca2+)が流入します。流入したCa2+は,カルモジュリン(CaM)と結合し,Ca2+/CaMとなりCaMKIIに結合することで,CaMKIIの構造変化を引き起こします。その後,CaMKII内の3か所(Thr286, Thr305, Thr306)でCaMKII自身による自己リン酸化反応が生じ,リン酸化したCaMKIIは,そのキナーゼ活性状態を長時間維持することが可能となります。このことが,CaMKIIが“記憶タンパク質”と呼ばれる理由の一つです。つまり,最初のCa2+信号によって引き起こされたシナプス後細胞内の反応を,CaMKIIのリン酸化によって長期間維持することで,信号を記憶するということです。
しかしながら,これらの知見は生化学や電子顕微鏡(静止画)から得られた推測であり,細胞内のような溶液環境でのCaMKIIの振る舞いは,40年にわたる研究においても分かっていませんでした。特に,CaMKIIの種による振る舞いの違いや自己リン酸化の状態とLTP(記憶の形成)やLTD(記憶の忘却)との関係,阻害剤の効果のメカニズムなど,多くの謎が残されています。
研究成果の概要
本研究では,高速原子間力顕微鏡(高速AFM)を用いて3種(ラット,ヒドラ,線虫)CaMKIIの構造ダイナミクスを,ナノメートルスケールの空間分解能で直接可視化することを試みました。高速AFMは,金沢大学が世界に先駆けて研究開発してきた顕微鏡技術で,これまでにさまざまなタンパク質のはたらく姿の動画撮影に成功しています。
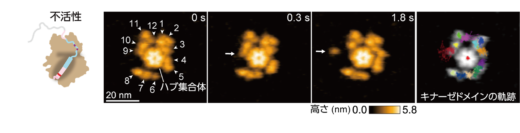
本研究グループは最初に,ラット由来のCaMKIIαを高速AFMで観察しました。その結果,CaMKIIαは主に12個の分子がリング状に集合し,花びらを広げたような美しいリング構造を取ることが分かりました(図2)。CaMKIIαの中心には各分子をつなぎ留めるハブ集合体があり,その周囲には,基質タンパク質をリン酸化するキナーゼドメインが点在し,ハブ集合体に対して円周方向へ自由に動く様子が観察されました(図2)。また,CaMKIIの阻害剤であるボスチニブの存在下では,キナーゼドメインの動きが大きく抑制されることが分かりました。動きの抑制メカニズムを,2光子蛍光寿命イメージング顕微鏡法(2pFLIM)(※2)を用いて調べたところ,ボスチニブの結合により,Ca2+/CaMのCaMKIIへの結合が著しく阻害されることが分かりました。ボスチニブはCaMKIIのATP結合サイトに強く結合することにより,キナーゼドメインと自己抑制セグメントとの親和性を高め,Ca2+/CaMを結合しにくい構造へと変化させることでCaMKIIの活性化を阻害していると考えられます。
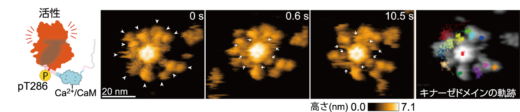
次に,CaMKIIαのCa2+/CaM結合状態の可視化を試みました。その結果,ハブドメインとキナーゼドメインの間にCa2+/CaMが結合した様子が見られ,12量体のリング構造が,外側に約3 ナノメートル伸びることが明らかになりました。このCaMKIIαの伸長構造では,キナーゼドメインの運動が制限され,リング内の隣接分子へのリン酸化が容易になる構造を取ることが示唆されました。さらに,自己リン酸化サイトであるThr286のみがリン酸化される条件(pT286)で高速AFM観察をしたところ,キナーゼドメインの運動の制限が解除されていることが明らかになりました(図3)。
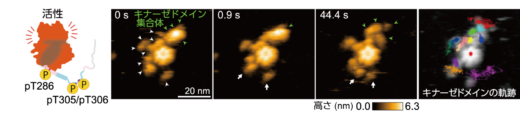
次に,3か所(Thr286/Thr305/Thr306)の自己リン酸化(pT286/pT305/pT306)により生じるCaMKIIαの構造ダイナミクスを高速AFMで可視化しました。その結果,中心のハブドメインから遠く離れ,非常に活発に動くキナーゼドメインと,隣り合うキナーゼドメインが集まってできた集合体(キナーゼドメイン集合体)が観察されました(図4)。
また,リン酸化サイトを欠損したT286AやT305A/T306V変異体を用いた実験から,3箇所すべてがリン酸化された場合にのみ,キナーゼドメイン集合体が形成されることが分かりました。キナーゼドメインの運動性の上昇は,CaMKIIのリン酸化領域が決まった構造を取らない天然変性領域へと変化したことに由来すると考えられます。一方で,CaMKIIαはリング構造のため,隣り合う分子が非常に近い位置に存在することになり,天然変性領域を介してキナーゼドメイン集合体が形成されたと推測されます。
CaMKIIのアミノ酸配列は,100万年以上に渡ってヒドラや線虫を含む後生動物間で高度に保存されています。私達は,ラット由来の CaMKIIαのキナーゼドメインの構造ダイナミクスが,他の種のCaMKIIでも保存されているのかどうかを調べました。その結果,ヒドラや線虫などの先祖型CaMKIIでも,自己抑制状態では,キナーゼドメインはハブ集合体の周りを自由に動き,キナーゼ活性状態であるCa2+/CaM結合やThr286リン酸化状態では,ラット由来のCaMKIIαと同様の伸長構造が観察されました。しかし,興味深いことに,ヒドラや線虫のCaMKIIでは,ラット由来のもので観察されたキナーゼドメイン集合体は観察されませんでした。
現時点では,キナーゼドメイン集合体の生理的な意義は未だ不明です。機能解析の結果からは,キナーゼ活性や脱リン酸化酵素への耐性に有意な差は見られませんでした。しかし,過去の研究から推測すると,CaMKII(pT286)は興奮性シナプスに局在し,CaMKII(pT286/pT305/pT306)は,抑制性シナプスに局在することが報告されています。もしかしたら,pT286/pT305/pT306状態でのキナーゼドメインの集合は,興奮性・抑制性シナプス間の移動に関わる分子メカニズムである可能性が考えられます。
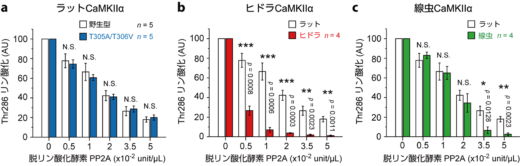
一方で,キナーゼドメイン集合体との相関はないものの,ラットのCaMKIIは,ヒドラや線虫のものと比較して脱リン酸化酵素への強い耐性を示しました(図5)。なぜ異なる種で,このような耐性が生じるのかはまだ解明されていません。しかし,高速AFM観察によると,ラット由来のCaMKIIαにおいては,pT286/pT305/pT306状態でのキナーゼドメインの移動範囲が,ヒドラや線虫のCaMKIIと比較して狭いことが明らかとなりました。もしかしたら,ラット由来のCaMKIIαでは,キナーゼドメインとハブ集合体の間のリン酸化部位に十分なスペースがなく,脱リン酸化酵素がアクセスしにくくなることで,耐性が生じるのかもしれません。この耐性によって,哺乳類のCaMKIIαはその活性を長期間にわたって維持することが可能となり,先祖型の動物とは異なる神経機能を実現できる可能性があります。
今後の展開
本研究では,記憶の形成や忘却を担うCaMKIIの多様な構造変化を詳細に明らかにしました(図6)。特に,ラット由来のCaMKIIではキナーゼドメイン集合体が形成され,これとは独立に,先祖型CaMKIIと比べて強い脱リン酸化酵素耐性を持つことが明らかになりました。しかし,キナーゼドメイン集合体の生理的な意義や種によるキナーゼドメイン集合体の生成メカニズムについては,さらなる検証が必要です。また,シナプスを構成するタンパク質は数百種類存在し,記憶の形成や忘却を分子レベルで完全に理解するためには,他のシナプスタンパク質のはたらく姿や,CaMKIIと協働してはたらく姿も明らかにする必要があります。高速AFMを用いた1分子イメージングが,その一端を担える可能性があり,今後の研究の進展が期待されます。
図1:電子顕微鏡画像に基づいて予想されたCaMKIIα の12量体構造モデル (a)とCaMKIIαサブユニットの活性化モデル(b)。各サブユニットが特定の条件化でリン酸化を受け,キナーゼ活性状態になる。
図2: ラット由来のCaMKIIαの連続する高速AFM画像。中央にハブ集合体が存在し,その周囲をキナーゼドメインが自由に動く様子が観察された。右の画像は,各キナーゼドメインの軌跡を示す。原著論文では動画を見ることができる。
図3: Ca2+/CaMが結合し,1つ目のリン酸化サイトThr286がリン酸化された状態にあるラット由来のCaMKIIαの連続した高速AFM画像。ハブ集合体とキナーゼドメインの間に結合したCa2+/CaMは白枠の点線と矢印で示す。右の画像は,各キナーゼドメインの軌跡を示す。原著論文では動画を見ることができる。
図4: ラット由来のCaMKIIαのpT286/pT305/pT306状態の連続した高速AFM画像。キナーゼドメインが広範囲に自由に動くものと(白の矢印),周囲で集合体を形成(緑の矢印)することが観察された。この集合体はラット由来のCaMKIIαに特有の構造である。右の画像は,各キナーゼドメインの軌跡を示す。原著論文では動画を見ることができる。
図5: pT268/pT305/pT306状態におけるCaMKIIの脱リン酸化酵素, PP2Aに対する耐性。ウェスタンブロッティングにより検出した。
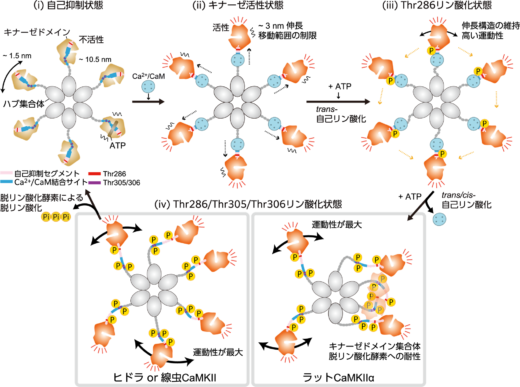
図6:高速AFMの結果により提唱されたCaMKIIαの活性化モデル。CaMKIIαは12量体であるが,このモデルでは単純化のために6量体として描かれている。(i) 自己抑制状態では,キナーゼドメインはハブ集合体の中心から約10.5 ナノメートルの範囲に分布し,自由に動くことができる。(ii) Ca2+/CaMの結合によるキナーゼ活性状態では,CaMKIIαは伸長構造を形成し,その移動範囲が制限される。(iii) Thr286リン酸化状態では,伸長構造は維持されるが,キナーゼドメインの移動範囲は広がる。(iv) Ca2+/CaMの解離によりThr305/Thr306が自己リン酸化され,Thr286/Thr305/Thr306リン酸化状態となる。この状態では,キナーゼドメインの運動性は最大となり,ラット由来のCaMKIIαではキナーゼドメイン集合体を形成される。一方,ヒドラや線虫由来のCaMKIIは集合体を形成しない。CaMKIIαのリン酸化状態は,脱リン酸化酵素による脱リン酸化が起こるまで持続する。
用語解説
掲載論文情報
- 論文タイトル
- Imaging single CaMKII holoenzymes at work by high-speed atomic force microscopy (高速原子原子間力顕微鏡による機能中のCaMKIIホロ酵素の1分子の振る舞い)
- 著者
- Shotaro Tsujioka, Ayumi Sumino, Yutaro Nagasawa, Takashi Sumikama, Holger Flechsig, Leonardo Puppulin, Takuya Tomita, Yudai Baba, Takahiro Kakuta, Tomoki Ogoshi, Kenichi Umeda, Noriyuki Kodera, Hideji Murakoshi, Mikihiro Shibata (辻岡尚太朗,角野歩,長澤祐太郎,炭竈享司,ホルガー・フレクシグ, レオナルド・プップリン, 富田卓也, 馬場雄大, 角田貴洋,生越友樹,梅田健一,古寺哲幸,村越秀治,柴田幹大)
- 掲載誌
- Science Advances
- 掲載日
- 2023.06.30
- DOI
- 10.1126/sciadv.adh1069
- URL
- https://www.science.org/doi/10.1126/sciadv.adh1069