メタボから幹細胞を守るしくみ,発見!
- 造血幹細胞(※1)には,極端に偏った食事により引き起こされる傷害やがん化を防ぐ仕組みが備わっていることを世界に先駆けて発見した。
- Spred1(※2)という分子が,造血幹細胞において高脂肪食摂取によるERKシグナル(※3)の活性化を抑制し,血液のがんである白血病の発症を防いでいることを発見した。
- Spred1が失われた場合,高脂肪食摂取によって発症する白血病は,腸内細菌叢(※4)の変化を介していることも判明した。
- 将来,白血病の予防や治療法の向上につながるものと期待される。
概要
金沢大学がん進展制御研究所/ナノ生命科学研究所(WPI-NanoLSI)の田所優子助教,平尾敦教授らの研究グループは,造血幹細胞には,極端に偏った食事により引き起こされる傷害やがん化を防ぐ仕組みが備わっていることを世界に先駆けて発見しました。
極端に偏った食生活,特に脂肪分の多い食事は,生活習慣病,いわゆるメタボリックシンドロームを引き起こすのみならず,がんの誘因になることが知られています。今回,本研究グループは,マウスを用いた実験により,Spred1という分子が,造血幹細胞において高脂肪食摂取によるERKシグナルの活性化を抑制し,血液のがんである白血病の発症を防いでいることを発見しました。さらに,Spred1が失われた場合,高脂肪食摂取によって発症する白血病は,腸内細菌叢の変化を介していることも判明しました。これらの知見は,ヒトの白血病の発症に,食生活の変化に伴う腸内細菌叢の異常が関与している可能性を示すものであり,将来,白血病の予防や治療法の向上につながるものと期待されます。本研究は,金沢大学,スタンフォード大学,中国医学科学院,東京大学,京都大学,大阪大学,慶應義塾大学,九州大学,がん研究会がん研究所との共同研究により行われました。
本研究成果は,2018年4月26日正午(米国東海岸標準時間)に米国科学誌「Cell Stem Cell」のオンライン版に掲載されました。
研究の背景・経緯
造血幹細胞は,全ての血液細胞を供給する血液の源の細胞です。造血幹細胞は,全ての血液細胞を産生する能力(多分化能)と共に,自身が失われないように自己を複製する能力(自己複製能)を兼ね備えています。私たちの体は,日々,炎症や活性酸素などさまざまなストレスにさらされていますが,一生涯にわたって血液細胞を供給し続けるためには,これらのストレスから造血幹細胞を守るシステムが必要であると考えられています。
最近,極端に偏った食生活,特に脂肪分の多い食事は,生活習慣病やがんなどさまざまな疾患の要因になることが知られています。しかし,このような極端に偏った食事が原因となるストレスが,造血幹細胞にどのような影響を与えているのかは,これまで明らかにはされていませんでした。
研究成果の内容
本研究グループは,これまで,造血幹細胞の自己複製に関わる分子やシグナルを研究してきました。その過程において,造血幹細胞の自己複製能はSpred1という分子によるROCKシグナル(※5)の制御によって調節されていることを発見しました。さらに,このSpred1は造血幹細胞において,サイトカイン(※6),加齢,放射線障害,細菌感染などの刺激によって活性化することを見いだしました。そこで,Spred1を欠損するマウスを用いて,造血幹細胞におけるSpred1の役割を調べました。Spred1欠損マウスは,通常の飼育条件では特に顕著な血液の異常を示しませんでしたが,上記のストレスを与えた際,野生型マウスでは造血幹細胞の傷害が観察されるのに対して,その傷害は軽減される,あるいは,通常より造血幹細胞の機能が亢進することが分かりました(図1)。このことから,Spred1は,造血幹細胞の自己複製を抑える機能を有するものの,通常の血液の産生において重要な役割を果たしているわけではないと考えられました。
次に,さまざまなストレスを負荷する実験を進めた結果,ラードを多く含む高脂肪食を与え続けると,Spred1欠損マウスは白血病を発症し,死亡することが分かりました。この時,高脂肪食を与えたSpred1欠損マウスの造血幹細胞では,その正常な機能が失われると同時に,ERKシグナルが異常に活性化し,白血病を引き起こすことが分かりました。このことから,Spred1は過剰な脂肪摂取によるがん化シグナルの活性化を抑制し,過栄養ストレスに対して造血幹細胞の機能を正常に保つ働きがあることが分かりました。
さらに本研究グループは,Spred1欠損マウスにおいて,過剰な脂肪摂取が白血病発症を誘導する原因について調べました。その結果,高脂肪食を与えたマウスでは通常食を与えたマウスに比べて腸内でのグラム陽性菌(※7)の割合が増えており,腸内細菌叢のバランスが崩れていることを見いだしました。そこで,高脂肪食を与えたSpred1欠損マウスに抗生物質を投与して腸内の除菌を行ったところ,造血幹細胞の機能低下や白血病の発症が抑制されました。以上のことから,高脂肪の食事は腸内細菌叢の変化を介して造血幹細胞の制御に影響を及ぼしていることに加え,通常ではSpred1がそのようなストレスから造血幹細胞が機能を失って白血病化しないように守っているが,そのシステムが破たんすると造血幹細胞に傷害を与え,白血病発症の原因になることを明らかにしました(図2)。
今後の展開
適切な食習慣を続けることは,健康を維持する上で最も重要な要素です。今回のマウスの実験では,たとえ,過剰な脂肪の摂取を続けても,通常は,Spred1が造血幹細胞の守護神として機能することによって,極端な血液異常の危険性を回避していると考えられました。しかし,最近の研究で,一部の白血病患者ではSpred1の発現低下が見られ,しかも,そのような患者は,そうでない患者より重い病状を示すことも分かってきました。つまり,何らかの原因でSpred1の機能が弱くなっている場合,暴飲暴食を続けると,血液の異常が生じる可能性も考えられます。今後,Spred1の機能調節機構や極端に偏った食生活に伴う腸内細菌叢の変化との関係を詳細に解析することで,白血病をはじめとする血液の異常を示す病態を解明することにつながると考えられます。さらに,研究を進めることによって,将来,白血病の予防や治療法の向上につながるものと期待されます。
本研究は,日本学術振興会科学研究費助成事業,文部科学省科学研究費補助金「ステムセルエイジングから解明する疾患原理」,文部科学省「世界トップレベル研究拠点プログラム」(WPI),ブリストル・マイヤーズスクイブ株式会社研究助成,国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業の支援を受けて実施されました。
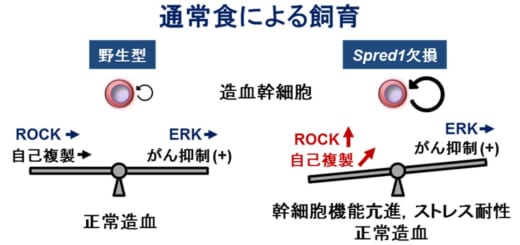
図1
通常食によるマウスの飼育において,野生型造血幹細胞は,ROCKシグナルによる自己複製調節とがん抑制機能によるERKシグナルの抑制はバランスが保たれており,正常造血を行います。一方,Spred1欠損造血幹細胞では,ROCKシグナルが活性化されて自己複製能の亢進やストレス耐性を示します。しかし,がん抑制機能は適度に保たれているので,白血病化せずに正常造血を行っています。

図2
高脂肪食を与えたマウスでは,腸内細菌叢のバランスが変化してしまいます。野生型造血幹細胞ではSpred1が存在することで,マウスは肥満になりますが,血液は正常です。一方,Spred1を欠損すると,ROCKシグナルの活性化に加えてERKシグナルの抑制が外れ,造血幹細胞は異常な自己複製を起こすようになります。その結果,Spred1欠損造血幹細胞は正常状態を保てずに,幹細胞機能を失い,重度の貧血を起こし,白血病を発症します。
用語解説
掲載論文情報
- 論文タイトル
- Spred1 safeguards hematopoietic homeostasis against diet-induced systemic stress
(Spred1は食餌により誘導される全身性のストレスから血液の恒常性を保護している) - 著者
- Yuko Tadokoro, Takayuki Hoshii, Satoshi Yamazaki, Koji Eto, Hideo Ema, Masahiko Kobayashi, Masaya Ueno, Kumiko Ohta, Yuriko Arai, Eiji Hara, Kenichi Harada, Masanobu Oshima, Hiroko Oshima, Fumio Arai, Akihiko Yoshimura, Hiromitsu Nakauchi, and Atsushi Hirao
(田所優子,星居孝之,山崎聡,江藤浩之,依馬秀夫,小林昌彦,上野将也,大田久美子,新井友里子,原英二,原田憲一,大島正伸,大島浩子,新井文用,吉村昭彦,中内啓光,平尾敦) - 掲載誌
- Cell Stem Cell
- 掲載日
- 2018.04.26
- URL
- https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(18)30164-4

