シャペロニンタンパク質GroELの2つのリング間のコミュニケーション
金沢大学ナノ生命科学研究所安藤敏夫特任教授と能代大輔博士研究員は、高速原子間力顕微鏡(高速AFM)を用いて,変性したタンパク質を正常な状態に戻す機能を持つ分子機械GroEL-GroESの動的な相互作用を直接観察し、詳細な反応機構の解明に初めて成功しました。また、その高効率な反応機構を支えるGroELの2つのリング間のコミュニケーションの解明にも成功しました。
細菌のGroELは、コシャペロニンGroESと連携して、変性したタンパク質分子を正常な構造へと戻す機能(シャペロニン機能)を持ちます。GroELは七量体サブユニットから成るリング2つが背中合わせに結合した分子で、14個のサブユニットそれぞれがATPを分解します。GroESは単一のリングで、GroELのヌクレオチド状態に依存してGroELリングの端に結合します。GroELのリング内側には変性した基質タンパク質を結合する空洞があり、GroESの結合は空洞に蓋をすることになります。14個のATP分解サイト、GroELの2つのリング、基質タンパク質、GroESといった複数の因子があるため、シャペロニン反応がどのように進行するかを解明することはこれまで困難でした。
本研究では、高速AFMを用いて、GroELの2つのリングで動的に起こるGroESの結合と解離を直接観察し(図1)、結合・解離の反応パターンとそれぞれの反応ステップの反応速度を精密に測定しました。基質タンパク質非存在下、異なる基質タンパク質存在下で測定しましたが、結果はこれらの条件に大きくは依存しませんでしたので、ここでは基質タンパク質依存性については説明を省きます。高速AFMで観察された反応中間体はGroESがGroELの片方のリングにのみ結合した複合体GroEL : GroES1と両方のリングに結合した複合体GroEL : GroES2がほとんどでした。それら複合体の形状から、前者はBullet(弾丸の意味)複合体(Bと略す)、後者はFootball複合体(Fと略す)と呼ばれます。また、GroESが結合したリングをシスリング、GroESが結合していないリングをトランスリングと呼びます。トランスリングが生ずる原因は、結合していたATPが分解してADP結合のリングになる結果、GroESが解離することにあります。従って、Footballでは、2つのリングのヌクレオチド状態は、ATP、ないしは、ADP−Piになっています。それぞれのリングは7個のサブユニットからなりますが、間接的な生化学データから、それぞれは独立にATPを分解せず、一斉に分解すると想定されています。反応パターンは大きく分けて2つあることが明らかになりました。主反応経路ではGroESの結合・解離がGroELの2つのリングで交互に起こります。すなわち、
B↑ → F → B ↓ → F
のようにリズミカルに進行します。ここで、縦方向の矢印は弾丸の尖った方(すなわち、GroESが結合した方)の向き(極性)を表わします。副反応経路では、主反応経路で起こるリズムがくずれ、
B↑ → F → B↑ → F
のように極性が反転しません(Fig. 1b; 5.52 s, 5.98 s, 6.21 sの像)。ここでは、主反応経路を中心に説明します。この経路では、2つのリングで交互に反応が進行しますから、2つのリングは互いのリングのヌクレオチド状態、或いは、GroESの結合・解離状態を感知しているはずです。このようにタンパク質内の遠隔部位間で起こる連絡をアロステリックコミュニケーションと呼びます。
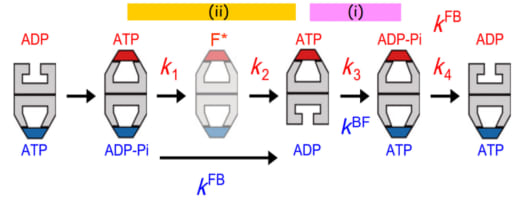
BulletとFootballの中間体の寿命から、B → F遷移の速度定数kBFと、F → B遷移の速度定数kFBの値が決定されました。高速AFM観察はATPとGroESの濃度がほぼ飽和濃度の条件下で行ったため、ATP結合とGroESの結合は瞬時に起こると見なせます。従って、kBFはGroESの結合していないリングからのADPの解離の速度を表わします。kFBは最初にできた(古い方の)シスリングからのGroESの解離速度ですので、そのリングに結合していたADP−PiからPiが解離する速度を表わします。これらの寿命解析に加え、Bulletのトランスリングに新たに結合したGroESが最終的にGroELから解離するまでの寿命の解析から、解離までに4つの中間体を経ることが明らかになりました。この結合時から解離までに高速AFMで観察される形の違う中間体は最初のFootball、次のBullet、及び、第二のFootballの3つですので、それら隣合う中間体間の遷移(速度)は2つで、最後の解離ステップの反応速度定数を含め3つしかないはずです。従って、形だけでは識別できない中間体がもうひとつあることになります。ここでは説明を省きますが、トランスリングにGroESが結合してできた最初のFootballのあとに、状態の異なるFootball(F*)が存在することが分かりました(図2)。最終的なGroESの解離も含め、これら状態間の遷移の速度定数、k1, k2, k3, k4の値が決定されました。驚いたことに、以下の3つの関係が現れました(図2参照)。
(1) k4 = kFB,
(2) k3 = kBF,
(3) 1/k1 + 1/k2 = 1/kFB
図2から明らかなように、k4とkFBは両方とも上のリングで起こる同じイベント(GroESの解離)の速度定数ですので、関係(1)は当たり前です。一方、k3は上のリングでの遷移イベントの速度定数であるのに対して、kBFは反対側のリングへのGroESの結合の速度定数ですので、関係(2)は2つのリング間にコミュニケーションがあることを意味します。関係(3)も同様です。
それでは、まず関係(2)が何を意味するか考察しましょう。kBFは下のトランスリングからのADPの解離速度、k3は上のシスリングで起こるATP → ADP−Piの加水分解速度です。これらの異なる遷移が同時に起こることから、ATPの加水分解反応が反対側のリングからのADPの解離をトリガーする、或いは、逆が成り立ちます。2つのリング間でコミュニケーションがなくトランスリングからのADPの解離が素早く起こると、瞬時にATPの結合とそれに続くGroES(蓋)の結合が起こるため、トランスリングから基質タンパク質が解離できなくなってしまいます。従って、ATPの加水分解がタイマーとなってADPの解離を遅らせトランスリングの状態をしばらく維持するようにしていると考えられます。関係(3)はどうでしょうか?残念ながら、F*が具体的にどのような状態なのか未解明のためすっきりした解釈は未だありませんが、上のリングにATPが結合したあとに起こる上のリングの何らかの変化(k2に対応する遷移;おそらく基質タンパク質を空洞へと導くための構造変化)と下のリングからのPiの放出がカップルしていることは確かです。このように、ATPの加水分解とPiの放出がそれぞれタイマーとなって、反対側のリングで対応するイベントが進んでいることが明らかになりました。
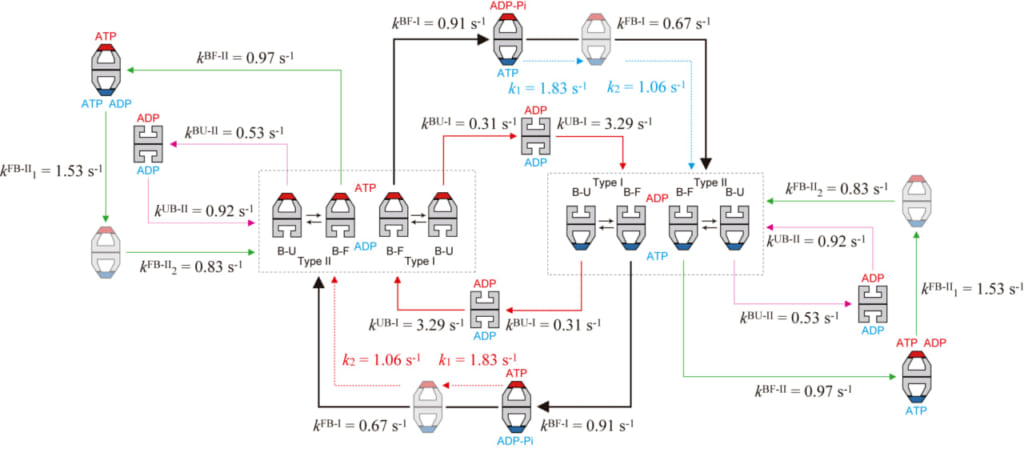
最後に、主・副反応経路の他にマイナーな経路も加え、シャペロニン反応サイクルの全貌を図3に示します(基質タンパク質として変性させたマルトース結合タンパク質を用いた場合)。この図から、シャペロニン反応がこれまで考えられていた以上に確率的に起こる複雑な反応であることが明らかになりました。このように複雑な入り組んだ反応は従来の観測手法では決して解明できません。高速AFMによる個々の分子、個々のリングで起こる反応進行の直接観察によって、詳細な反応経路が初めて解明されました。副反応経路は1/3−1/4という比較的高い確率で起こりますので、主反応経路からの分岐はたまたま偶然に起こるものではなく、何らかのメカニズムで起こっているはずです。この問題はシャペロニン反応について今後解明すべき重要課題のひとつです。
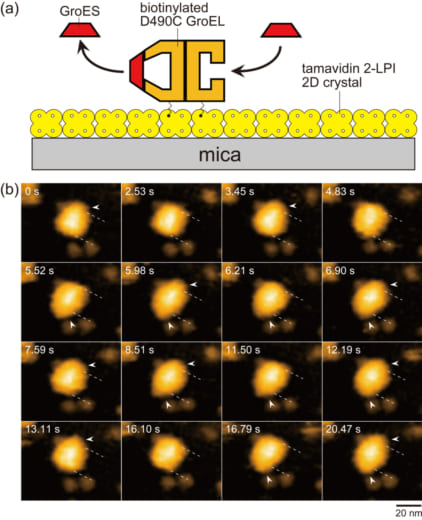
図1. 動的なGroEL–GroES相互作用の高速AFM観察のためのアッセイ系と撮られた像。
(a) 高速AFMイメージングに使われたアッセイ系の模式図。Tamavidin 2-LPI をマイカ表面上で直接二次元結晶化した。赤道ドメインに局在する Cys490でビオチン化したGroEL D490Cを長さ約2.5 nmのリンカーを介してタマビジンの二次元結晶表面に繋げた。この結晶表面は非特異的にタンパク質を結合しないため、繋げられたGroELは結晶表面に吸着しない。(b) 変性させたマルトース結合タンパク質(MBP)存在下で繰り返し観察されたGroELの2つのリングで起こるGroESの結合と解離を示す高速AFM像。示した像は1秒当たり4.35フレームの速度で連続撮影された像から抜き出したものである。破線はGroEL分子の端の位置を示す。矢じりはGroELに結合したGroESを示す。FootballとBullet複合体の他に、GroESが結合していないGroELが2.53, 4.83, 16.10 sに観察された。溶液には1 μM GroES, 2 mM ATP, 200 nM 変性 MBPが含まれている。
図2. GroELの2つのリング間で生ずるアロステリックコミュニケーション。
薄い色で示すFootball複合体(F*)は直前のFootball複合体と見かけ上同じだが、反応動力学的に異なる。GroESの結合寿命の分布は4つの速度定数k1, k2, k3, k4で表わされる連続的な4つのステップ反応モデルによくフィットした。これらの反応速度定数は上側のリングで起こる状態遷移に対応する。青字で示す速度定数kFBとkBFは下側のリングで起こるF → BとB → F遷移に対応する。2つのリング間で同期して起こる反応ステップを(i)と(ii)でマークされた横長の帯で示す。
図3. 変性MBD存在下での高速AFMイメージングで解明されたGroEL–GroES相互作用の動力学的反応スキーム。
反応経路に沿った黒、赤、緑の実線矢印の太さは出現の頻度を表わす。赤の破線矢印は赤で示すGroESに結合したリングで起こる反応プロセスを、青の破線矢印は青で示すGroESに結合したリングで起こる反応プロセスを示す。k1FB-IIとk2FB-IIの順序、及び、k1とk2の順序は仮定したものである。副反応経路において描かれているひとつのリング中でのATPとADPの共存も仮定したものであるが、副反応経路が生ずる原因である可能性が高い。
掲載論文情報
- 論文タイトル
- Substrate protein dependence of GroEL-GroES interaction cycle revealed by high-speed AFM imaging
- 著者
- D. Noshiro and T. Ando
- 掲載誌
- Philosophical Transactions Royal Society B
- 掲載日
- 2018.05.07
- DOI
- /10.1098/rstb.2017.0180
- URL
- http://doi.org/10.1098/rstb.2017.0180