世界初!細菌べん毛タンパク質輸送の交通整理のしくみを解明―FlhAホモログを直接ターゲットにした創薬スクリーニングが可能に―
- べん毛タンパク質輸送装置の構成タンパク質であるFlhAの細胞質ドメインを高速原子間力顕微鏡で解析することにより,FlhAが9量体リングを形成するしくみを解明した。
- FlhAリングの構造変化によりタンパク質輸送装置の基質特異性が変化することを解明した。
- 細菌感染症に関わるFlhAホモログを直接ターゲットとした細菌感染症薬のスクリーニングへの応用が期待される。
概要
大阪大学大学院生命機能研究科の寺原直矢特任助教(常勤),井上由美特任技術職員(研究当時。現・京都大学大学院医学研究科教務補佐員),難波啓一特任教授,南野徹准教授,同大学院理学研究科の今田勝巳教授,金沢大学新学術創成研究機構ナノ生命科学研究所の古寺哲幸教授,安藤敏夫特任教授,名古屋大学大学院理学研究科の内橋貴之教授,九州工業大学大学院情報工学研究院の森本雄祐助教の共同研究グループは,細菌べん毛タンパク質輸送の交通整理のしくみを世界で初めて明らかにしました。
サルモネラ属菌はべん毛と呼ばれる運動器官を使って最適な環境へ移動します。べん毛は約30種類のタンパク質が数分子から数万分子重合(※1)してできた超分子複合体(※2)です。べん毛は,回転モーターとして働く基部体,ユニバーサルジョイントのフック,らせん型プロペラである繊維の,3つの部分構造で構成されます(図1)。べん毛基部に存在する独自のタンパク質輸送装置(※3)は,フックの構築中にはフックタンパク質を輸送します。フックの長さが55 nmに到達すると,輸送装置はフックタンパク質の輸送を停止し,繊維形成に関わるタンパク質の輸送を開始します。これまでに,フックの長さを測定するしくみや,フックの完成に伴って起こるタンパク質輸送装置の基質特異性(※4)の切り替わるしくみについては詳細に解析されてきました(図2)。しかし,輸送装置が輸送するタンパク質の種類を切り替える,いわば輸送の交通整理のしくみは長い間謎のままでした。
今回,共同研究グループは,高時間高空間分解能で生体分子の観察が可能な高速原子間力顕微鏡(※5)を用いて,世界で初めて膜タンパク質(※6)であるFlhAの細胞質ドメイン(※7)(以降,FlhACと呼ぶ)のリング形成過程をリアルタイムで可視化することに成功しました。FlhAの膜貫通ドメインとFlhACを繋ぐリンカー領域(※8)の一部が隣のFlhACに結合することで協働的に9量体リング(※9)が形成されること,リンカー領域とFlhACとの相互作用によってフックタンパク質の輸送が停止して繊維タンパク質の輸送が開始することを明らかにしました。本研究成果は,べん毛タンパク質輸送の交通整理のしくみの解明への第一歩とともに,べん毛タンパク質輸送装置と機能的にも構造的にも同じしくみを持つ,病原性細菌のIII型分泌装置(※10)のFlhAホモログ(※11)を直接ターゲットにした創薬スクリーニング(※12)が可能になると期待されます。
本研究成果は,米国科学誌「Science Advances」に,4月26日(木)午前3時(日本時間)に公開されました。
研究の背景・経緯
べん毛は基部体,フック,繊維の,3つの部分構造からなります。べん毛は細胞の内から外に向かって基部体,フック,繊維の順に構築され,べん毛の先端,すなわち細胞から遠い側の端にべん毛構成タンパク質が順序正しく重合することで構築が進みます。べん毛の根元に存在する独自のタンパク質輸送装置がべん毛の構築過程に応じて必要なタンパク質を必要量輸送します。タンパク質輸送装置はフック構築中に時折分子物差しであるFliKを送り出すことで,フックの構築状況をモニターすることができます。フックの長さが55 nmになると,FliKがその長さ情報を輸送装置構成タンパク質FlhBに伝え,その結果,輸送装置の基質特異性が切り替わることで,フックタンパク質の重合が停止して繊維形成が開始します。しかしながら,輸送装置がどのようにして輸送するタンパク質の種類を変化させるのかは謎のままでした。
研究成果の内容
共同研究グループは,べん毛タンパク質の輸送に直接関与し,9量体リング構造を作って働く輸送装置タンパク質FlhAに着目し,高速原子間力顕微鏡によりFlhACの動的構造解析を行いました。その結果,FlhACは9量体リングを形成すること,細胞膜貫通ドメイン※13と繋がるリンカー領域が協働的な9量体リング形成に必須であること,9量体リング形成に関わる重要なアミノ酸が異なるアミノ酸に置換されると9量体リングが形成されなくなるとともに,タンパク質輸送装置の基質特異性がスイッチしないことなどが明らかになりました。以上の結果から,フックが完成すると,FlhAのリンカー領域が隣のFlhAC分子に協働的に結合することでFlhACリングの全体構造が大きく変化し,その結果フックタンパク質の輸送が停止し,繊維形成に関わるタンパク質の輸送が開始することが示唆されました(図3)。
本研究は長い間謎であったタンパク質輸送装置の輸送基質認識モードの切り替えのしくみの可視化に成功するとともに,べん毛タンパク質輸送の交通整理のしくみを明らかにしました。今後は,本研究成果をもとに,フック完成に伴って過渡的にしか存在しないフック完成シグナリング複合体※14の形成とその機能発現のしくみの解明が期待されます。
今後の展開
抗菌剤は細菌感染症対策の主流ですが,多剤耐性菌の出現により治療困難な感染症が増え,新たな着眼点からの感染症対策が急務となっています。病原細菌が感染する際に用いるIII型分泌装置は細菌特有のもので,しかも,病原細菌の生存に必須ではありません。もし,III型分泌装置の働きだけを不活化できる薬剤が見つかれば病原細菌の病原性のみを破壊することが可能となります。III型分泌装置は機能的にも構造的にもべん毛タンパク質輸送装置と似ていますので,本研究成果によりIII型分泌装置の構成タンパク質であるFlhAホモログを直接ターゲットにした創薬スクリーニングが可能となり,社会的な重要課題である新興細菌感染症を制御するための新技術開発に貢献すると期待されます。
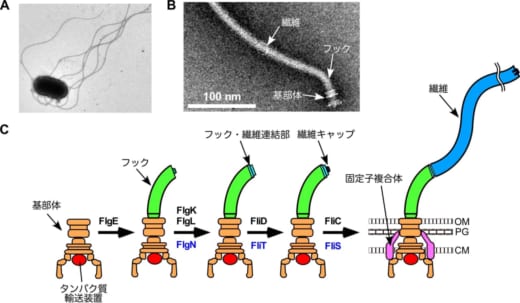
図1 細菌べん毛の構造
(A) サルモネラ属菌の電子顕微鏡写真
(B)サルモネラ属菌から単離精製された電子顕微鏡写真
(C)べん毛の構築過程.OMは外膜,PGはペプチドグリカン層,CMは細胞膜を示す。

図2 一時的に形成されるフック完成シグナリング複合体の模式図.
時折細胞外に送り出されるFliKがフックの長さを測定する分子物差しとして働く。フックの長さが55 nmになると,FliKのC末ドメインが輸送スイッチであるFlhBと相互作用し,その結果タンパク質輸送装置の基質特異性が切り替わる。

図3 FlhAのリング形成
(A)FlhAの結晶構造.結晶中でリンカー領域が隣のFlhAC分子に結合している様子。
(B) FlhACリングの高速原子間力像。リンカーが欠失されると(右),リング形成が著しく阻害される。
(C) FlhACリング構造のリモデリング仮説。FlhAのリンカー領域がFlhACサブユニットに結合すると,FlhACリングの構造が変化し,その結果フックタンパク質の輸送が停止して繊維タンパク質の輸送が開始する。
用語解説
掲載論文情報
- 論文タイトル
- Insight into structural remodeling of the FlhA ring responsible for bacterial flagellar type III protein export
- 著者
- Naoya Terahara, Yumi Inoue, Noriyuki Kodera, Yusuke V. Morimoto, Takayuki Uchihashi, Katsumi Imada, Toshio Ando, Keiichi Namba and Tohru Minamino
- 掲載誌
- Science Advances
- 掲載日
- 2018.04.26
- DOI
- 10.15252/embr.201744523
- URL
- http://embor.embopress.org/cgi/doi/10.15252/embr.201744523
Funder
本研究は,科学研究費補助金,科学技術振興機構(JST)戦略的研究推進事業CRESTおよびさきがけ研究の一環として行われ,大阪大学大学院理学研究科 今田勝巳教授,金沢大学新学術創成研究機構ナノ生命科学研究所 安藤敏夫特任教授と古寺哲幸教授,名古屋大学大学院理学研究科 内橋貴之教授,さらには九州工業大学大学院情報工学研究院 森本雄祐助教の協力を得て行われました。

