分子ナノゲート核膜孔複合体分子が細胞の運命を決定する仕組みを解明
- 上皮組織幹細胞の自己複製を調節する転写因子(※1)p63の核内移行を制御する核膜孔複合体分子「ヌクレオポリン62(NUP62)」とその調節機構を明らかにした。
- 上皮細胞分化を誘導するROCKキナーゼ(※2)によるNUP62へのリン酸化修飾はp63の核内移行を抑え,効率的な細胞分化の進行に関わることを示した。
- 核膜孔複合体による転写因子の核内移行制御は,遺伝子発現から細胞の運命決定に関わる生命現象の要となるプロセスであり,その仕組みを明らかにしたことはがんの病態解明・創薬ターゲットの重要な基盤となる。
概要
金沢大学新学術創成研究機構革新的統合バイオ研究コアセルバイオノミクスユニットおよびナノ生命科学研究所(WPI-NanoLSI)のリチャード・ウォング教授,羽澤勝治助教らの研究グループは,核膜における「分子ナノゲート(核膜複合体)」が転写因子p63の核内移行を調節する仕組みを明らかにしました。
核を覆う核膜には分子輸送をするためのナノポア(核膜孔,直径約100 ナノメートル(nm))が存在し,この核膜孔は30種類の分子から成る核膜孔複合体により形成されます(図1)。幹細胞が適切に性質を維持し,機能するためには,核膜孔複合体による分子輸送が秩序立って進められることが重要です。転写因子p63は多層上皮組織幹細胞や,これらに由来するがん細胞の自己複製・未分化維持に関わる遺伝子の発現を制御することが知られています。しかし,p63が核内へ移行するメカニズムの詳細は,今まで明らかになっていませんでした。
今回,本研究グループは,核膜孔複合体分子がp63を核内へ移行する過程を詳細に解析し,p63が核内へ移行する過程で,フェニルアラニン-グリシン(FG)-ヌクレオポリン(※3)の一つであるNUP62のFG領域が介在していることを明らかにしました。さらに,上皮分化を誘導することで知られるROCKキナーゼによってFG領域のリン酸化を受けたNUP62は,p63を核内輸送する能力が減少することを見いだしました。これらにより,核膜孔複合体は細胞内環境に応じて変化し,効率良く細胞の運命を方向づける分子ナノゲートとして機能することが分かりました。
本研究成果は,2017年12月7日正午(英国時間)発行の欧州科学雑誌「EMBO Reports」のオンライン版に掲載されました。
研究の背景・経緯
遺伝子情報(DNA)は細胞の性質を決定する生命の設計図であり,DNAは核に存在します。核を覆う核膜には分子輸送をするための核膜孔が存在し,この核膜孔は30種類の分子から成る核膜孔複合体により形成されます。幹細胞が適切に性質を維持し,機能するためには,核膜孔複合体による分子輸送が秩序立って進められることが重要です。また,p63は個体の発生から一生を通じて,体表を覆う多層上皮組織(皮膚,口腔内上皮,食道)の構築・再生に欠かせない転写因子です。多層上皮組織に由来する扁平上皮がん(SCC:Squamous Cell Carcinoma)では,p63の遺伝子増幅(※4)が起こり,過剰につくられたp63は核内へ移行後,標的遺伝子の発現を誘導することでSCC細胞の悪性化シグナルを活発にします。これまで,p63の活性化する標的遺伝子とこれらの機能については知られていましたが,p63が核内へ移行するメカニズムの詳細は明らかになっていませんでした。
研究成果の内容
本研究グループは,多層上皮組織における核膜孔複合体分子の発現様式を解析し,以下のことを明らかにしました。
- 多層上皮組織における核膜孔複合体分子の中で幹細胞の性質維持に関連する分子, NUP62を同定しました。
- NUP62の発現量を抑制した細胞において,p63の核内移行が有意に遮断されていることを見いだしました(図2(A))。
- NUP62の発現量を抑制した細胞は増殖能力が低下し,上皮分化遺伝子の発現量が上昇することを明らかにしました(図2(B)(C))。
- NUP62の発現量を抑制した細胞の遺伝子発現様式をマイクロアレイ法で明らかにし,この遺伝子発現変化に基づくパスウェイ解析の結果から,p63の核内移行にはセリン・スレオニンキナーゼの一つであるROCKキナーゼが関与していることが分かりました。
それでは,どのようにROCKキナーゼはNUP62が介在するp63核内移行に関わるのでしょうか。まず,NUP62フラグメントペプチド発現プラスミドベクターの導入実験や免疫沈降法により詳細に解析した結果,p63がNUP62に存在するFGドメインと結合することは,p63の核内移行に重要であることが分かりました(図3)。次に,ROCKキナーゼはこのFGドメインをリン酸化すること,このリン酸化を受けたFGドメインはp63との結合能力が著しく低下することが分かりました(図3)。本研究から,分化へと方向づけられた幹細胞内で活性化したROCKキナーゼは,リン酸化修飾によりNUP62の機能を弱め,未分化状態の維持に関わるp63の核内輸送を遮断することが分かり,ROCKキナーゼと核膜孔複合体の連携による効率的な細胞分化誘導メカニズムが明らかになりました。
これまで,核内へ運ばれる分子に必要な条件はインポーチン分子(※5)と複合体を形成することでした。今回の研究から,核膜孔複合体は細胞環境を察知することで状態が変化し,インポーチン分子という核内移行ライセンスが破棄され,細胞の運命決定に最適な分子ナノゲートを構築することが明らかにされました。
このような核膜孔複合体分子の状態・機能転換をもたらすメカニズムと選択的な分子輸送との関連性の解明は,高次な細胞機能制御機構の理解を深め,分子輸送関連疾患の病態の理解・治療法解明の基盤となるものです。
今後の展開
本研究により,核膜において分子ナノゲートとして機能する核膜孔複合体分子の性質は,細胞環境に応じて活性化するリン酸化キナーゼにより調整され,細胞の運命を方向づけるユニークな分子輸送場を構築することが明らかになりました。このリン酸化修飾による核膜孔複合体の性質変化は可逆的であるため,特異的リン酸化キナーゼ阻害剤により,人為的に分子ナノゲートを制御し,転写因子の核内移行・遺伝子発現を操作できる可能性を示唆するものであり,分子輸送関連疾患の新たな治療技術への応用が期待されます。
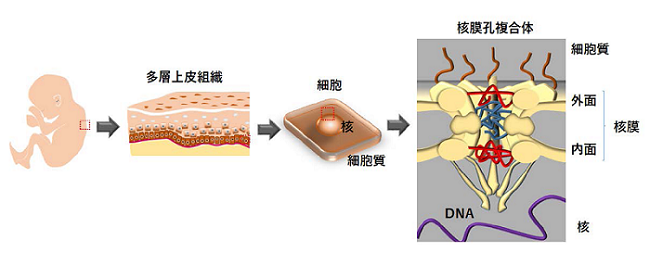
図1 核膜を貫き,分子輸送ルートを構築する核膜孔複合体
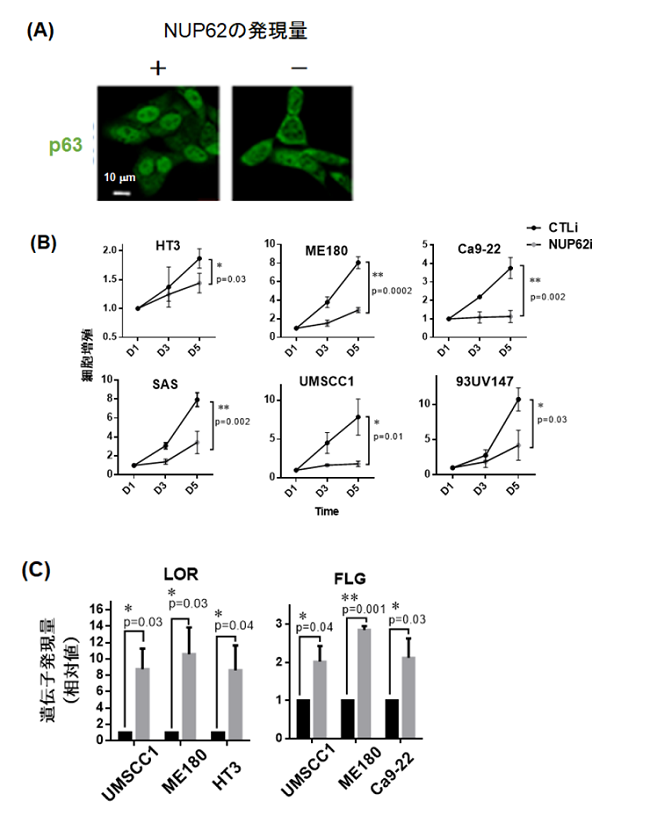
図2 p63の核内輸送を制御するNUP62
NUP62の発現量をノックダウンした細胞ではp63(緑色)の核内移行が抑制される(A)。このとき,扁平上皮がん細胞の増殖能力は低下し(B),上皮細胞分化マーカー(LOR,FLG)の発現量は上昇した(C)。
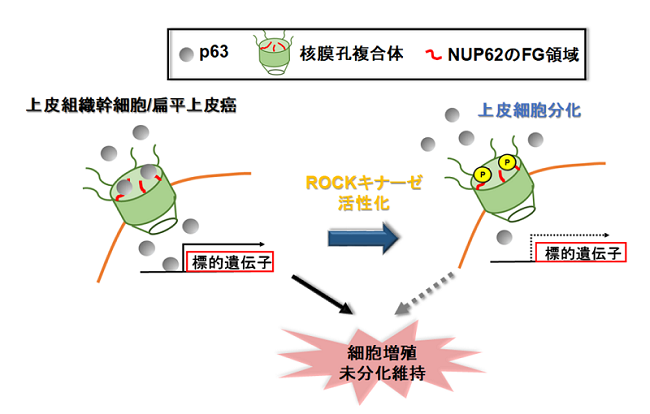
図3 ROCKキナーゼによるNUP62のFG領域リン酸化修飾によるp63核内移行メカニズム
増殖期にある細胞において,p63はNUP62のFG領域との相互作用を介して核内へ輸送される。しかし,上皮分化シグナルROCKキナーゼの活性化により,NUP62のFG領域のリン酸化はp63との結合性が弱くなり,p63の核内移行は遮断される。
用語解説
掲載論文情報
- 論文タイトル
- ROCK-dependent phosphorylation of NUP62 regulates p63 nuclear transport and squamous cell carcinoma proliferation
(ROCKキナーゼによるNUP62分子のリン酸化修飾はp63の核内移行と扁平上皮癌の細胞増殖を制御する) - 著者
- Masaharu Hazawa†, De-Chen Lin, Akiko Kobayashi, Yan-Yi Jiang, Liang Xu, Firli Rahmah Primula Dewi, Mahmoud Shaaban Mohamed, Hartono, Mitsutoshi Nakada, Makiko Meguro-Horike, Shin-ichi Horike, H. Phillip Koeffler, Richard W. Wong†
(羽澤勝治†,De-Chen Lin, 小林亜紀子, Yan-Yi Jiang, Liang Xu, Firli Rahmah Primula Dewi, Mahmoud Shaaban Mohamed, Hartono, 中田光俊, 目黒牧子, 堀家慎一, H. Phillip Koeffler, Richard W. Wong†)
†:責任著者 - 掲載誌
- EMBO Reports
- 掲載日
- 2017.12.07
- DOI
- 10.15252/embr.201744523
- URL
- http://embor.embopress.org/cgi/doi/10.15252/embr.201744523
Funder
本研究は,日本学術振興会科学研究費助成事業,金沢大学新学術創成研究機構ユニット研究推進経費,同機構若手PI研究経費,文部科学省「世界トップレベル研究拠点プログラム」(WPI),金原一郎記念医学医療振興財団の支援を受けて実施されました。

