小型CRISPR-Cas9がDNAを切断する瞬間を撮影!
金沢大学ナノ生命科学研究所のLeonardo Puppulin特任助教(研究当時), ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授,東京大学先端科学技術研究センターの西増弘志教授らの共同研究グループは,高速原子間力顕微鏡(高速AFM)(※1)を用いて,黄色ブドウ球菌由来の小型CRISPR-Cas9(※2), SaCas9がDNAを切断する瞬間を動画として撮影することに成功しました。
近年,標的DNA切断による「ゲノム編集」(※3)技術は,生命科学に革命をもたらしました。特に,細菌がもつDNA切断酵素CRISPR-Cas9を応用したゲノム編集技術は,基礎研究から臨床研究まで多岐に渡る生命科学分野において広く利用されています。しかしながら,意図しないDNA配列の編集(オフターゲット)が,Cas9のより広い使用に向けて依然として大きな制限となっており,Cas9によるDNA探索・結合・切断のダイナミクスを完全に理解することは,ゲノム編集の安全性を高めるために極めて重要と考えられています。今回,本研究グループは,黄色ブドウ球菌由来の小型CRISPR-Cas9, SaCas9の観察に高速AFMを用い,RNA結合状態において,開いた構造と閉じた構造を遷移する様子や,SaCas9がDNA切断後すぐにDNAから離れる様子をリアルタイムで可視化することに成功しました。
当研究グループは,2017年にもCas9の中で最も有名なSpCas9のDNA切断過程の動画撮影にも成功しており,さまざまなゲノム編集ツールの網羅的な解析を進めています。これまでの研究成果と合わせて,本研究成果はCas9のDNA切断分子作動メカニズムの深い理解につながり,ゲノム編集技術のさらなる高度化を目指した基盤研究となることが期待されます。
本研究成果は,2023年2月27日(米国東部時間)に米国科学誌『ACS Nano』にオンライン掲載されました。
研究の背景
2020年のノーベル化学賞受賞が示すように,CRISPR-Cas9を利用した「ゲノム編集」技術は,近年大きな脚光を浴びています。ゲノム編集とは,生命の設計図ともいえるゲノム情報を意図して書き換える技術であり,生命科学において,基礎研究から,動植物の品種改良や疾患の治療といった応用研究に至るまで,幅広い分野で利用されている革新的なバイオテクノロジーです。ゲノム編集には,さまざまな細菌に存在するCas9と呼ばれるDNA切断酵素が活躍します。最も代表的なCas9は,化膿性連鎖球菌(Streptococcus pyogenes)由来のSpCas9で,その詳細な立体構造やDNA切断における構造ダイナミクスは,さまざまな実験方法により,その全貌が明らかになりつつあります。私たちの研究グループも,2017年に高速AFMを用いてSpCas9のDNA切断における「ハサミ」の役割を担う部位(HNHドメイン)の構造変化を可視化することに成功し,「ハサミ」がどのように動くのかを明らかにしました。このように,SpCas9はゲノム編集に最もよく使われ,その分子作動機構の研究も進んでいますが,その一方で,タンパク質自体が大きいため細胞への導入効率が低いという問題点がありました。そんな中,ゲノム編集に利用されるCas9が,さまざまな細菌から相次いで発見され始めます。その中の一つ,黄色ブドウ球菌(Staphylococcus aureus)で発見されたSaCas9は,タンパク質自体の大きさが小さく,細胞への導入効率も高いことが分かり,高効率なゲノム編集に向けて大きく期待されています。しかし,SaCas9のDNAへの結合や切断時の構造ダイナミクスは,これまで不明でした。
研究成果の概要
今回,本研究グループは,高速AFMを用いて,SaCas9がはたらく一連の様子を動画として撮影することに成功しました。高速AFMは,金沢大学が世界にさきがけて研究開発した顕微鏡技術で,水溶液中にある生きたままの生体分子の動きをナノメートル(10億分の1メートル)の空間分解能で,かつ,数十ミリ秒の時間分解能で撮影することができます。最初に,SaCas9単体(RNAもDNAも結合してない状態)での高速AFM観察を行いました。Cas9タンパク質はタンパク質の中でたくさんのドメインが正しく重なることで立体構造を形成します(図1)。ところが,SaCas9単体では,安定な立体構造をとらず,非常に柔軟な構造をとることが分かりました(図2)。一方,SaCas9を標的DNA配列まで運ぶ役割を担うRNAと結合した, SaCas9-RNA複合体においては,2つの球状ドメインが互いに向かい合う構造をとることが分かりました(図3)。このRNAによるCas9の立体構造の安定化は,SpCas9でも見られ,RNAがタンパク質の立体構造の安定化に重要な役割を担うことを強くサポートする結果となりました。また,SaCas9では,2つの向かい合った球状ドメインが閉じたり開いたりする動きを持つことが分かりました(図3中の4.0 秒と4.6秒の画像を比較)。さらに,標的DNAに結合したSaCas9-RNA-DNA結合状態では,三つ葉のクローバーのような構造を形成し,全てのドメインにおいて,安定な構造を形成することが分かりました(図4)。過去に報告したSpCas9の場合では,DNA切断に重要な「ハサミ」部分であるHNHドメインがフラフラとよく動く様子が観察されていましたが,SaCas9ではそのような様子は見られず,固く安定した立体構造を形成することが分かりました。さらに,DNAの切断時には,HNHドメインが切断部位まで移動し,DNA切断後すぐにDNAから離れる様子が観察されました(図5)。これまでの研究から,SaCas9は1分子において何度もDNAを切断できる機能を持つことが報告されており,高速AFMでとらえた現象は,SaCas9の機能をサポートする結果であると考えられます。これに加えて,高速AFM基板上でSaCas9-RNA複合体が標的配列DNAへ結合する瞬間の画像もとらえ,SaCas9における新たなDNA結合メカニズムの可能性も示しました。
今後の展開
以上のように,SaCas9単体,SaCas9-RNA複合体,および,SaCas9-RNA-DNA複合体によるDNAの切断といった一連の過程を撮影した高速AFM動画と,これまでに報告したSpCas9との高速AFM動画の比較から,CRISPR-Cas9によるDNA切断ダイナミクスの統一的な理解を得ることができました。また,本研究で仮定した標的DNA探索の分子メカニズムを検証するために,今後,他の種に由来するCas9や,その変異体を含めた,さらなる実験結果の積み上げが必要となります。本研究により得られた動的な構造情報は,より安全なゲノム編集ツール開発の基盤となることが期待されます。
参考図
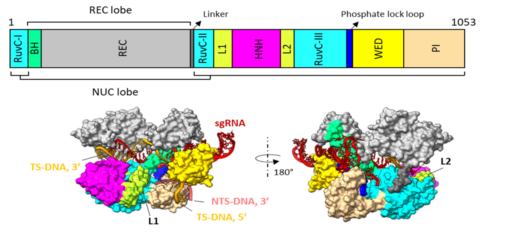
図1:SaCas9のドメイン構造(上)と結晶構造(下)
SaCas9はいくつかの部分(ドメイン)から構成される。HNHおよびRuvCと呼ばれるドメインが「ハサミ」としてはたらき,二本鎖DNAを切断する。
図2: SaCas9単体の高速AFM動画
図3: SaCas9-RNA複合体の高速AFM動画
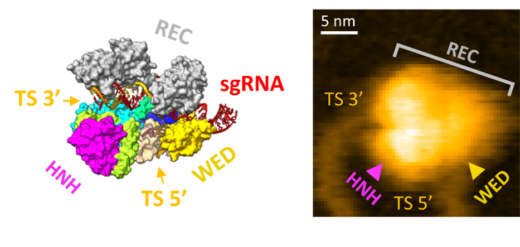
図4: SaCas9-RNA-DNA複合体の結晶構造(左)と高速AFM画像(右)の比較
図5: SaCas9-RNA-DNA複合体のDNA切断時の高速AFM画像
Posted March 3, 2023
研究者情報
用語解説
掲載論文情報
- 論文タイトル
- Dynamics of target DNA binding and cleavage by Staphylococcus aureus Cas9 as revealed by high-speed atomic force microscopy
(高速原子間力顕微鏡により明らかとなった黄色ブドウ球菌由来のSaCas9のDNA結合と切断ダイナミクス) - 著者
- Leonardo Puppulin, Junichiro Ishikawa, Ayumi Sumino, Arin Marchesi, Holger Flechsig, Kenichi Umeda, Noriyuki Kodera, Hiroshi Nishimasu, and Mikihiro Shibata
(レオナルド・プップリン, 石川潤一郎, 角野歩, アリン・マルケシ, ホルガー・フレクシグ, 梅田健一, 古寺哲幸, 西増弘志, 柴田幹大) - 掲載誌
- ACS Nano
- 掲載日
- 2023.02.27
- DOI
- 10.1021/acsnano.2c10709
- URL
- https://doi.org/10.1021/acsnano.2c10709