遺伝子発現制御に重要なヒストンを含むヌクレオソームが1秒以内にDNA上をスライディングする現象を発見!
金沢大学大学院自然科学研究科数物科学専攻博士前期課程の森岡新さん,金沢大学ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授らの研究チームは,東京大学定量生命科学研究所の胡桃坂仁志教授らの研究グループおよび京都大学大学院工学研究科/金沢大学ナノ生命科学研究所の生越友樹教授らの研究グループとの共同研究で,遺伝子発現制御に重要なヒストンタンパク質H2A.Zを含むヌクレオソーム(※1)が,わずか0.3秒の時間スケールでDNAに沿って移動する「ヌクレオソームスライディング」の様子を高速原子間力顕微鏡(高速AFM)(※2)を用いて世界で初めて撮影することに成功しました。
真核生物では,ヒストンバリアント(※3)などのエピゲノム(※4)が,生命の本質ともいえる遺伝子発現の制御に重要な役割を担っています。ヒストンバリアントの一種であるH2A.Zは,遺伝子の転写活性領域と抑制領域の両方に高度に集積すること,また,その遺伝子欠損マウスが,ほとんどが生存できないという実験事実から,生体内で非常に重要な役割をもつことが知られています。しかしながら,H2A.Zが遺伝子発現の制御に活性(プラス)にも抑制(マイナス)にもはたらく,その分子メカニズムはほとんど分かっていませんでした。そこで本研究では,精製したH2A.ZとDNAをもとに,H2A.Zを含むヌクレオソームを試験管内で再構成し,その1秒以下のナノ動態を高速AFMを用いて直接可視化することを試みました。その結果,H2A.Zを含むヌクレオソームが,自発的に0.3秒以内の時間スケールでDNAに沿って移動すること(ヌクレオソームスライディング)を発見しました。さらに,H2A.Zのアミノ酸残基を主要型であるH2Aのアミノ酸残基へ入れ替えた変異体を解析することにより,H2A.ZのN末端に位置するアミノ酸残基がこのヌクレオソームスライディングに関与していることを明らかにしました。
今回の研究では,ヌクレオソームのダイナミクス観察という観点において,エピゲノムによる遺伝子発現制御の分子メカニズムの一端を明らかにしました。この高速AFMによるヌクレオソームのナノ動態観察は,今後,遺伝子発現制御の分子メカニズムに対して新しい知見を提供することが期待されます。
本研究成果は,2023年2月13日(米国東部時間)に国際学術誌『Nano Letters』にオンライン掲載されました。
研究の背景
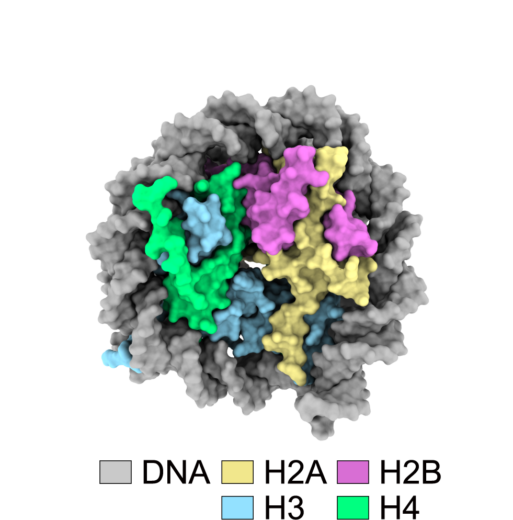
私たちの体内のゲノムDNAは,細胞の核内でさまざまなタンパク質と複合体を形成することで高次に折りたたまれ,ヌクレオソームを基本単位としたクロマチン構造を形成しています。ヌクレオソームは,4種類のヒストンタンパク質(H2A, H2B, H3, H4)が各2分子ずつ集まった円盤状のヒストン八量体と,その周りにDNAが巻き付いた安定な構造をしています(図1)。ところが,ゲノムDNAは非常にコンパクトに収納されている一方で,遺伝情報を読み取る際には,ヌクレオソームスライディングやDNAのアンラッピングのような読み取り部分の露出が必須で,生命活動の維持には,ヌクレオソームはダイナミックな構造変化を起こしているものと考えられています。また,ヒストンタンパク質には主要型ヒストンと亜種(ヒストンバリアント)が存在し,細胞周期とは無関係に,ヒストンバリアントが主要型ヒストンと置き換わるようにヌクレオソームに取り込まれることにより,さまざまな遺伝子発現の制御が達成されています。特に,H2AのヒストンバリアントであるH2A.Zは転写の活性と抑制の両方に関与すること,熱安定性が低いこと,同じDNA配列上でも複数のヌクレオソーム構造を形成することが知られており,この不安定な構造は,その機能と密接な関係があるものと考えられましたが,これまで,生理的条件下(室温,非結晶状態,液中)での1分子レベルのダイナミクスは明らかにされていませんでした。
研究成果の概要
本研究チームは,H2A.Zを含むヌクレオソームに高速AFMを適用することで,0.3秒以下で起こる新たなヌクレオソームダイナミクスを発見しました。
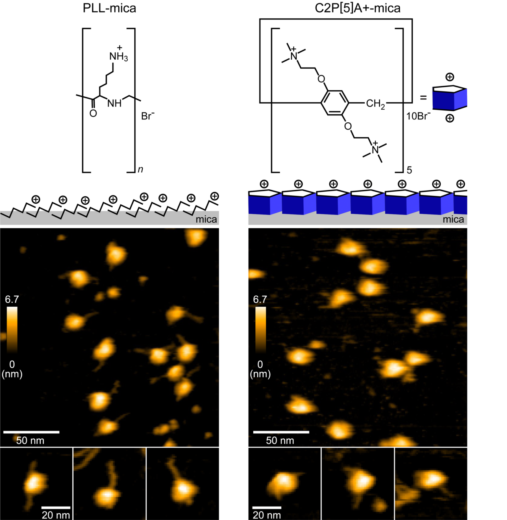
高速AFMは,生理環境(室温,非結晶状態,液中)にある生体分子の生きた動きそのものを高い時空間分解能(1 ナノメートル, 0.3秒以下)で可視化できる顕微鏡技術であり,これまでも本研究チームにより,さまざまなタンパク質のはたらく姿が映像として発表されています。研究チームはまず,ヌクレオソームの構造や動態を乱さない高速AFM基板の最適化に取り組みました。一般に,高速AFM観察には,基板とよばれる原子レベルで平坦な台の上に生体分子を固定する必要があります。しかしながら,これまでに使われていた基板でヌクレオソームの高速AFM観察を行うと,固定する力が強すぎるためか,ヌクレオソームに本来巻き付いているはずのDNAが剥がれ落ち,基板側へ強く固定される様子が多く観察されました(図2左)。そこで我々は,弱い正電荷を有し,AFM基板上で単分子層を形成する特徴をもつピラー[5]アレーン(※5)に着目し,高速AFM基板に適用しました。その結果,本来のヌクレオソーム構造を壊すことなく,その構造と動態を観察できることを見い出しました。(図2右)。
このピラー[5]アレーン基板を用い,H2A.Zを含むヌクレオソームの高速AFM観察を行ったところ,ヒストン八量体で構成される円盤部分がDNAに沿ってコロコロとスライディングする様子を撮影することに成功しました(図3)。その移動距離は,約4 ナノメートルであり,高速AFMの時間分解能である1フレーム0.3秒で完結する動きでした。また,コントロール実験として,主要型H2Aを含むヌクレオソームの観察を行ったところ,スライディング現象はほとんど見られなかったことから,この現象は,H2A.Zに特徴的であることが分かりました。さらに,研究チームは,このヌクレオソームスライディングが起こる構造的要因を調べるために,H2A.Zの1-63残基(N末端側)と64-127残基(C末端側)を主要型H2Aの1-60残基と61-129残基にそれぞれ置換した変異体を作成し,高速AFM観察を行いました。その結果,H2A.Zの1-63残基を主要型へ置換したヌクレオソームではスライディングは観察されず,64-127残基を置換したヌクレオソームでは同様にスライディングが観察されました。これらの結果は,H2A.ZのN末端部分にあるアミノ酸残基とDNAとの相互作用の欠損が,DNAとの相互作用を弱くし,H2A.Zを含むヌクレオソームにおいてスライディング現象を起こしたものと考えられます。H2A.Zを含むヌクレオソームにおける顕著なスライディング現象は,安定したヌクレオソームを形成するモデルDNA配列で再構成したヌクレオソームだけでなく,生体内に存在する遺伝子発現調節領域のDNA配列を用いた場合においても観察され,DNA配列に依存しない現象であることも確かめられました。
このように,高速AFMを用いて,H2A.Zを含むヌクレオソームのヒストン八量体が0.3秒の時間スケールでDNAに沿ってスライディングする現象を発見することができました。この現象は,H2A.Zを含むヌクレオソームが,遺伝子の転写を制御する機能と関係している可能性があります。例えば,ヌクレオソームスライディングによりヒストン八量体から露出されたDNA配列は転写因子がアクセスしやすくなり(活性),一方,スライディングによりヒストン八量体へ巻き付いたDNA配列はアクセスしにくくなる(抑制),といった分子メカニズムが考えられます。
今後の展開
ヒストンバリアントやヒストンの翻訳後修飾を含むエピゲノムは,遺伝子発現制御に極めて重要な役割を担っています。本研究では,ヌクレオソームのダイナミクス観察という観点で,エピゲノムにおける遺伝子発現制御の分子メカニズムの一端を明らかにしました。この高速AFMによるヌクレオソームの動態観察は,今後,遺伝子発現制御の分子メカニズムに対して新しい知見を提供するものと期待されます。特に,ヌクレオソームが複数連なった,より生体内に近いクロマチン構造での観察により,遺伝子発現制御のナノレベルでの詳細な分子メカニズムの解明を目指します。
参考図
図1:ヌクレオソーム構造
ヌクレオソームはヒストンH2A-H2B二量体2つとH3-H4二量体2つからなるヒストン八量体にDNAが巻き付いた複合体です。
図2:従来のAFM基板(PLL, 左図)と今回用いたAFM基板(C2P[5]A+, 右図)の比較
従来用いられていたAFM基板を使ってヌクレオソームの観察をしたところ,DNAが基板に強く結合し,DNAがヌクレオソームから剥がれた構造が観察されました。一方,ピラー[5]アレーンをAFM基板に用いた場合,DNAが剥がれた様子は観察されませんでした。
図3:高速AFMで観察したヌクレオソームスライディング
(上図)主要型H2Aを含むヌクレオソームの連続した高速AFM画像。(下図)H2A.Zを含むヌクレオソームの連続した高速AFM画像。1フレーム0.3秒で撮影。高速AFMの映像から,H2A.Zヌクレオソームの球状(ヒストン八量体)の部分が,ひも状に見えるDNA上に沿って自発的にスライディングをすることが明らかとなりました。原著論文では,このスライディング現象を動画で見ることができます。
用語解説
掲載論文情報
- 論文タイトル
- High-Speed Atomic Force Microscopy Reveals Spontaneous Nucleosome Sliding of H2A.Z at the Subsecond Time Scale (高速原子間力顕微鏡により明らかとなったH2A.Zの1秒以下のヌクレオソームスライディング現象)
- 著者
- Shin Morioka, Shoko Sato, Naoki Horikoshi, Tomoya Kujirai, Takuya Tomita, Yudai Baba, Takahiro Kakuta, Tomoki Ogoshi, Leonardo Puppulin, Ayumi Sumino, Kenichi Umeda, Noriyuki Kodera, Hitoshi Kurumizaka, Mikihiro Shibata (森岡新,佐藤祥子,堀越直樹,鯨井智也,富田卓也, 馬場雄大, 角田貴洋,生越友樹,レオナルド・プップリン,角野歩,梅田健一,古寺哲幸,胡桃坂仁志,柴田幹大)
- 掲載誌
- Nano Letters
- 掲載日
- 2023.02.13
- DOI
- DOI:10.1021/acs.nanolett.2c04346
- URL
- https://doi.org/10.1021/acs.nanolett.2c04346