SARS-CoV-2スパイクタンパク質に対する中和抗体の 作用機序を高速原子間力顕微鏡で可視化することに成功
金沢大学ナノ生命科学研究所のキイシヤン・リン特任助教と大学院新学術創成研究科ナノ生命科学専攻博士後期課程の西出梧朗さん,エルマ・サキナトゥス・サジダさん,医薬保健研究域医学系/ナノ生命科学研究所の山野友義准教授,ナノ生命科学研究所の安藤敏夫特別功績教授,華山力成教授,ナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らの共同研究において,高速原子間力顕微鏡(高速AFM)(※1)を用い,SARS-CoV-2スパイクタンパク質とその中和抗体(※2)の相互作用をリアルタイムかつ3Dで捉えることに世界で初めて成功しました。
SARS-CoV-2(新型コロナウイルス)は,ウイルス表面のスパイクタンパク質をヒト細胞表面のアンジオテンシン変換酵素2(ACE2)に結合させることにより,細胞内への侵入を開始します。現在国内でも接種が実施されている新型コロナワクチンは,この機構を利用してウイルスの体内侵入を抑制するものです。ワクチンを接種することで,私たちの体にはスパイクタンパク質に対する中和抗体が作られ,この中和抗体がスパイクタンパク質に結合してウイルスがACE2に結合することを防ぎ,ウイルス感染を抑制します。また,この中和抗体自体をCOVID-19患者へ注入する中和抗体療法も,重症化を防ぐ手段として用いられています。ゆえに,中和抗体がどのようにスパイクタンパク質に結合するのか,またどのような環境でその結合が増強,あるいは弱くなるのかを明らかにすることは大変重要です。しかし,中和抗体は15ナノメートル前後と非常に小さいため,その動態を直接リアルタイムで捉えることは困難でした。
本研究では高速AFMを用いることにより,中和抗体がスパイクタンパク質に結合する様子をナノレベル,リアルタイムかつ3Dで捉えることに成功しました。これまでにリン特任助教らは,スパイクタンパク質が細胞内の環境変化に合わせ,効率よく細胞内に侵入するために構造変化を起こすことを見出していましたが,本研究ではさらに抗体が結合することによりこれらの構造変化が起こらなくなることを明らかにしました。高速AFMが SARS-CoV-2のみならず,さまざまなウイルスに対する中和抗体の作用機序を評価できる強力なツールであることが示されたと言えます。こうした成果は,高い時空間分解能(ナノ秒,ミリ秒レベル)で,定性的,定量的なデータを提供することができる高速AFMでの計測によって,初めて得られたものであり,将来,さまざまなナノ生体材料の評価ツールとして活用されることが期待されます。
本研究成果は,2023年1月15日(米国東部時間)に国際学術誌『Nano Letters』にオンライン掲載されました。
研究の背景
SARS-CoV-2は,ウイルスの表面にあるスパイクタンパク質をヒトの細胞膜上のACE2タンパク質と結合させ,細胞への侵入を開始します。SARS-CoV-2のスパイクタンパク質に結合し,ACE2との結合を阻害する作用を持つ抗体は「中和抗体」と呼ばれ,一般的な抗体とは異なります。
中和抗体の物理的な特性評価は非常に重要です。従来の原子間力顕微鏡(AFM)でも,中和抗体のナノ構造変化を可視化することはできましたが,その画像は静的なスナップショットであるため,測定の時間分解能は低く,ミリ秒単位での動的な変化をリアルタイムで観察・測定することは不可能でした。一方,本研究で用いた高速AFMは,高い時空間分解能を持つ強力なナノイメージングツールで,カンチレバーによってサンプルを穏やかにタッピングすることにより,試料にダメージを与えることなく,ミリ秒単位で画像を取得することができます。高速AFMを用いることで,ウォング教授と華山教授らはこれまでに,ウイルスタンパク質,ヒストンへのDNAラッピング,真核生物のオルガネラ(核膜孔と細胞外小胞)のナノ構造変化を直接可視化することに成功しています。
研究成果の概要
COVID-19の患者数は,全世界で6億人以上確認されています。SARS-CoV-2のスパイクタンパク質はウイルスが体内へ侵入する際の先鋒であり,このスパイクタンパク質に対する抗体は,中和抗体として宿主免疫反応の引き金となっています。現在,COVID-19の予防と治療のために,スパイクタンパク質に対する中和抗体が開発されています。しかしながら,これまでにスパイクタンパク質と中和抗体の動的な相互作用をナノレベルで解析することは困難でした。本研究では,高速AFMを用い,スパイクタンパク質に対する抗体MM43とスパイクタンパク質との相互作用を観察することにより,抗体の結合特性と,中和抗体としての機能の2つを同時に判定するナノスコープ評価プラットフォームを開発しました(図1)。まず研究チームは,SARS-CoV-2のモデルとしてスパイクタンパク質を表面に発現する細胞外小胞を作製し,MM43との相互作用を高速AFMによりリアルタイムで可視化しました。MM43は低密度ではY構造を持つ単量体として現れ,高密度では6量体のオリゴマーを形成しました。スパイクタンパク質の中でも特にその変異や動きに関係するドメインであるスパイクタンパク質受容体結合ドメイン(RBD)は,通常,ウイルスが細胞内に効率よく侵入できるように,構造が大きく変化しますが,抗体が結合すると,構造変化が起こりませんでした。さらに,この相互作用はpHが変わっても変化しませんでした。抗体の中には期待通りに機能せず,逆にウイルスの働きを増強する(抗体依存性感染増強(Antibody-dependent enhancement):ADE)ものも存在しますが,これらの結果からMM43には,ADEリスクはほとんどないことが分かりました(図2)。
今後の展開
これらの結果は,高速AFMが,COVID-19の治療において,ADEリスクの低い適切な中和抗体をスクリーニングする優れたツールであることを示しています。この方法はMM43に限らず,臨床グレードにある中和抗体や,ADE関連の抗スパイクタンパク質抗体にも適用可能であると考えられます(図3)。さらに近い将来,高速AFMは,活動中および回復期のCOVID-19患者の血清から得られた抗スパイクタンパク質モノクローナル抗体の研究にも用いられ,新しい中和抗体や新たなADEメカニズムの発見に役立つものと考えられます。
研究資金
本研究は,武田科学振興財団ビジョナリーリサーチ助成(研究テーマ:「新型コロナウイルスのタンパク質のナノ立体構造変換反応と構造創薬への開発」),文部科学省世界トップレベル研究拠点プログラム(WPI),日本学術振興会科学研究費助成事業(19K23841, 20K16262, 21H05744 , 21K19043 22H02209, 22H05537),科学技術振興機構CREST (No. JPMJCR18H4),小林国際奨学財団,島津科学技術振興財団,金沢大学新学術創成研究機ユニット研究推進経費,金沢大学超然プロジェクト,金沢大学「新型コロナウイルス感染症対策支援ファンド」研究費の支援を受けて実施されました。
参考図
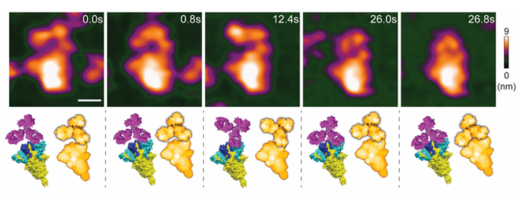
図1:高速AFMによる動的な中和抗体―スパイクタンパク質の相互作用の可視化
(上段)MM43がスパイクタンパク質の受容体結合ドメイン(RBD)にリアルタイムで結合している様子。(下段)中和抗体とスパイクタンパク質の分子構造のシミュレーション画像により,相互作用の方向を示している(scale bar,25 nm)。

図2:中和抗体-スパイクタンパク質相互作用のナノスコープ観察により,中和抗体の治療適用評価が高精度に可能となる。
(i)(ii)高速AFMを用いたMM43のナノスケール観察により,MM43の本来の構造(i)とオリゴマー化といった固有の性質(ii)が明らかとなった。
(iii)高い時空間分解能により,高速AFMはMM43とスパイクタンパク質の動的な相互作用とその結合パターンを捉えることができる。
(iv)中性または酸性 pH におけるMM43とスパイクタンパク質複合体のコンフォメーションを直接可視化することで,RBD の「閉」-「開」遷移,S1 サブユニットの脱落,抗体の脱落などADEに関連する重要な情報が得られる。
(v)スパイクタンパク質発現細胞外小胞は,MM43 や SARS-CoV-2 相互作用のナノレベルにおける追跡を行う上で安全な代替物質である。スパイクタンパク質発現細胞外小胞のトポロジーと細胞外小胞表面のスパイクタンパク質の動的な動きは,SARS-CoV-2ウイルスに類似している。
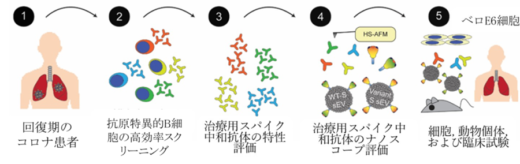
図3:高速AFMが治療に適用可能な中和抗体のナノレベルでの評価に役立つ。
- COVID-19から回復した患者は,SARS-CoV-2に対する免疫を獲得している。
- 抗原特異的B細胞のハイスループットスクリーニングを行う。
- 中和抗体を分離し,その治療効果をさらに評価する。
- 高速AFMを用いたこれらの候補のナノスケール評価は,より良い中和抗体を選択するために不可欠な情報を提供できる。
- 選択された中和抗体は,その治療効果を検証するために,下流のin vitroおよびin vivo実験ならびに臨床試験に使用される。
プレスリリースはこちら
研究者情報:Keesiang Lim、華山 力成、Richard W. Wong
用語解説
掲載論文情報
- 論文タイトル
- Nanoscopic assessment of anti-SARS-CoV-2 spike neutralizing antibody using high-speed AFM(高速AFMによる抗SARS-CoV-2スパイク中和抗体のナノスケール評価 )
- 著者
- Keesiang Lim, Goro Nishide, Elma Sakinatus Sajidah, Tomoyoshi Yamano, Yujia Qiu, Takeshi Yoshida, Akiko Kobayashi, Masaharu Hazawa, Toshio Ando, Rikinari Hanayama, Richard W. Wong
- 掲載誌
- Nano Letters
- 掲載日
- 2023.01.15
- DOI
- 10.1021/acs.nanolett.2c04270
- URL
- https://doi.org/10.1021/acs.nanolett.2c04270

