ペプチドの自己組織化過程を分子レベルで可視化 することに成功!
金沢大学ナノ生命科学研究所のアイハン・ユルトセベル特任助教,孙林豪(リンハオ・スン)特任助教,福間剛士教授と,米国・ワシントン大学のメフメト・サリカヤ教授の共同研究グループは,周波数変調原子間力顕微鏡(FM-AFM)(※1)を用いて,遺伝子工学的に設計したペプチドがグラファイト表面上で自己組織化(※2)することで一分子の厚さの結晶層を形成することを,液中ナノスケール観察により明らかにしました。
ペプチドはタンパク質と同じくアミノ酸から構成されていますが,タンパク質が数百から数千個のアミノ酸から構成されるのに対し,ペプチドは10~30個と少数のアミノ酸から構成されており,タンパク質と類似の機能を持った小型版として注目されています。しかし,分子が小さいため決まった構造をとらず,その機能の予測も難しいと考えられてきました。
ペプチドは,応用を目的として遺伝子工学的に設計する試みも行われており,中には固体表面で自己組織化するものが存在しています。その詳細な構造や形成過程はほとんど解明されていませんが,もし解明が進めばペプチドの機能予測の手がかりになる可能性があります。そのためには,ナノスケールで,かつ生体分子が機能する液中で計測することが不可欠です。福間剛士教授らにより独自に開発された液中FM-AFM技術は,液中でサブナノスケールのその場観察(※3)が可能な方法です。本研究では,この液中FM-AFM技術を使い,「指向性進化法(※4)」により合成したペプチドが,グラファイト表面に特異的に吸着して自己組織化結晶を形成する様子を捉えることに成功しました。本研究グループによって,液中でのペプチド分子計測手法を確立したことは,ペプチドの機能予測につながり,その生体分子としての機能を活かしてナノデバイス等へ応用する道が拓けます。
これらの知見は,バイオロジーとテクノロジーの両方で用いることが出来るハイブリッド生体分子ナノデバイスの設計に必要不可欠であり,将来,アミノ酸配列によって制御される機能的な構造を設計するための指針を与え,バイオエレクトロニクス,バイオセンサー,タンパク質アレイなどの複合技術のプラットフォームとなる可能性が期待されます。
本研究成果は,2023年3月1日(米国東部時間)に米国科学誌『ACS Nano』のオンライン版に掲載されました。
研究の背景
小さなタンパク質として知られるペプチドの中には,MoS2やグラファイトなどの固体表面において自己組織化するものが存在しています。このような自己組織化ペプチドは,ナノセンサーやバイオエレクトロニクスなどのデバイス設計に必要な分子プラットフォームを提供するために重要であり,近年関心を集めています。ペプチドが働いている環境である液中において,分子スケールで構造制御を行うためには,ナノスケールの高い空間分解能でペプチドが多次元的に自己組織化する過程やその構造を詳細に理解することが要求されています。しかし,これまで,液中でナノスケールの測定を行う方法がなく,その理解は進んでいませんでした。
研究成果の概要
本研究グループの金沢大学 福間剛士教授らは,液中での高分解能の測定が可能な周波数変調(FM)を用いたFM-AFM技術を開発し,さらに近年は測定の高速化も実現しています。金沢大学 アイハン・ユルトセベル特任助教とワシントン大学のメフメト・サリカヤ教授らのグループは、この液中FM-AFM技術を用いて、「指向性進化法」により合成したグラファイト特異的に吸着するペプチドが、多次元的に自己組織化していく様子を,ナノスケールでその場観察することに成功しました(図 1)。
その結果,グラファイト上に接しているペプチドの第1層目は非常に均質であり,下地のグラファイトの影響により,格子構造を持つ自己組織化結晶が生成されていることが明らかになりました(図 2)。また,第2層目は,第1層の結晶欠陥が引き金となって形成されることに加えて,1層目とは異なり,ほとんどが不均質な構造を取っていることが確認されました。さらに,自己組織化によって形成される結晶構造や核の形成速度は,溶液中に含まれるペプチド濃度に大きく依存することを示しました。特に、高濃度のペプチド溶液中で形成される結晶はペプチド分子1個が構成単位となり、低濃度ではペプチド分子2個が構成単位となることを、AFM観察と分子力動学シミュレーションの結果から明らかにしました(図 3)。
今後の展開
本研究により,グラファイト吸着性ペプチドがグラファイトの原子格子を認識するだけでなく,自身もまた結晶を形成し,ペプチドと固体との間に連続したソフトな界面を確立することを発見しました。ペプチドの自己組織化過程において生じる複雑な表面現象の詳細な理解は,タンパク質やペプチドのアレイ,バイオエレクトロニクス,生体分子デバイスなどのハイブリッドな表面技術に用いるための分子設計の基本指針に貢献することが大きく期待されます。
現在、研究チームは,変異体やペプチド周辺の水和構造,他の固体基板への影響などのさらなる課題解決に取り組んでおり,その知見は生物に着想を得た次世代技術開発のための確固たる科学的基盤を確立する基礎になります。
参考図
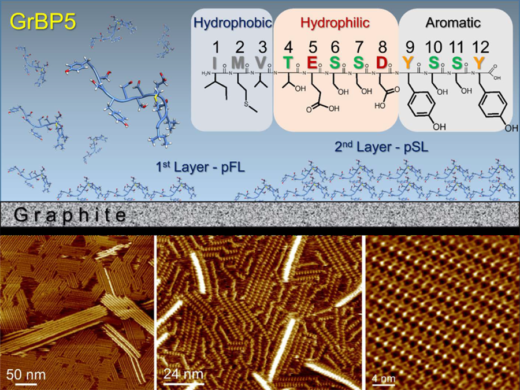
図1 (上部)グラファイト吸着性ペプチドと表面現象。アミノ酸配列から,このドデカペプチドは化学的に異なる3つのドメインから構成されていることがわかる。起こり得る表面現象を模式的に示す。(下部)水溶液中で取得した自己組織化ペプチドナノ構造体の分子分解能AFM像。左の画像では,第1層の上に第2層が部分的に形成されている。中の画像の明るい部分では,第2層が形成され始めている。

図2 グラファイト表面での自己組織化分子ドメイン(第1層)の形成と成長を示すFM-AFM画像(5 μM溶液)。(a)ペプチド結晶ドメインが60°と120°の角度で交差する部分を含む画像。(b)A,B,Cの3つのペプチド結晶ドメインの分子スケール像。FFT像とフィルター像の中に,格子定数a,bを示した。(c)に結晶と格子定数の対応関係を示す。格子定数の平均値は,a1 = 9.20 nm,a2 = 4.60 nm,b1 = 1.65 nm, b2 = 0.85 nm (±0.05)。(d) 10分以上にわたる結晶部分の列ごとの成長。表面で拡散しているペプチド分子が成長中の列に結合している(黄色矢印)。解析の結果,毎分5分子が列に結合していることがわかった。
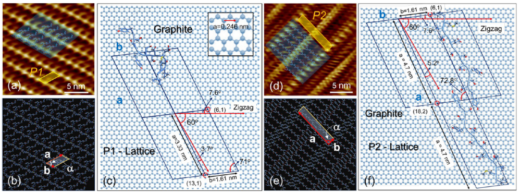
図3 完全に自己組織化された第1層のペプチド結晶の構造。(a-c)は高濃度(100μM以上),(d-f)は低濃度(10μM以下)ペプチド条件下で形成される結晶構造。(a,d)は高解像度AFM像,(b,e)はペプチド結晶格子のモデルを示す。(c,f)左はペプチド分子1個、右はペプチド分子2個が構成単位となっている。本研究のシミュレーションでは,この2種類の構造を使用している。
研究者情報
用語解説
掲載論文情報
- 論文タイトル
- Molecular Scale Structure and Kinetics of Layer-by-Layer Peptide Self-Organization at Atomically Flat Solid Surfaces (原子レベルで平坦な固体表面におけるペプチドの層状自己組織化の分子スケール構造とキネティクス)
- 著者
- Ayhan Yurtsever, Linhao Sun, Kaito Hirata, Takeshi Fukuma, Siddharth Rath, Hadi Zareie, Shinji Watanabe, and Mehmet Sarikaya (アイハン・ユルトセベル,リンハオ・スン,平田海斗,福間剛士,シッダルタ・ラス , ハディ・ザレイエ,渡邉信嗣,メフメト・サリカヤ)
- 掲載誌
- ACS Nano
- 掲載日
- 2023.03.01
- DOI
- 10.1021/acsnano.2c10673
- URL
- https://doi.org/10.1021/acsnano.2c10673

