ヒト細胞の運命決定を紐解く:革新的な生細胞イメージング技術による遺伝子発現と細胞機能の可視化

宮成悠介 金沢大学ナノ生命科学研究所 准教授・Jr. PI
ヒトゲノムプロジェクトによってゲノム配列が解読され、DNAとタンパク質の複合体より構成されるクロマチン繊維が化学修飾(エピジェネティクス修飾)されることによって、ヒト染色体が機能を発揮することが明らかになった。しかし、遺伝子発現の調節メカニズム、さらに、細胞が分化して異なる機能を発揮するようになる原因はまだ十分には理解されていない。たとえば、皮膚細胞と心筋細胞は、全く同じDNA配列を有しているにも関わらず、異なる表現型を示す。
2020年4月に金沢大学ナノ生命科学研究所WPIのライフサイエンスグループの一員となった宮成悠介准教授は、この分野の研究に貢献するため、細胞運命決定を支配する分子メカニズムを研究している。宮成准教授は、遺伝子発現制御のメカニズムを理解するために、クロマチンの高次構造に焦点を当てている。この研究は、ヒトの遺伝子発現制御を解明することによって、がん等の病気の原因究明につながることが期待されている。
九州大学薬学部から京都大学へ -ウイルス複製メカニズムを可視化する
「私は九州大学で薬学の学士号を取得しました」と宮成准教授は言う。「特に薬学に興味があったわけではありません。学部で勉強した私の進路としては、製薬会社で働くか、薬剤師になって自分の薬局を設立するか、あるいは研究者になるかの3つの選択肢がありました。私は研究者になることを決心し、C型肝炎ウイルスの複製についての研究を京都大学博士課程ではじめました。その博士課程における研究は、現在の研究活動の根幹といっても過言ではないです。」
博士号を取得するために発表した論文の中で宮成准教授は、C型肝炎ウイルスの粒子形成に、細胞内の油の塊(脂肪滴)が重要な役割を担うことを報告した [1]。免疫蛍光イメージングと電子顕微鏡の組み合わせにより、「脂肪滴が感染性ウイルス粒子の現場である」ことが明らかとなり、ウイルスがどのように細胞機能を利用して、増殖するのかを示したものである。
細胞核ダイナミクスに関する研究 -日本とフランスで-
博士号を取得した後、宮成准教授は静岡県三島市にある国立遺伝学研究所(遺伝研)に移った。遺伝研での宮成准教授の研究テーマの一つは、「標的反復配列のDNAメチル化状態をイメージングする技術in situハイブリダイゼーション(MeFISH)の開発でした」[2]。「ヒト細胞における特定のと宮成准教授は説明する。
2009年、宮成准教授はフランスのストラスブールにある遺伝学分子細胞生物学研究所(IGBMC)のMaria-Elena Torres-Padilla研究室に移った。「IGBMCでの5年間は、多能性幹細胞の研究[3]と、標的DNA配列の生体内でのイメージング技術TGV法の開発[4]に貢献することができました。」と宮成准教授は説明する。「これは、細胞核のダイナミクスを可視化する上での大きな進歩でした。 また、日本とフランスの研究アプローチの違いを直接目にすることもできました。例えば、私のいた研究室では、最小限のデータで、インパクトの大きい科学雑誌に投稿していました。これは、多くのデータを事前に準備する日本のやり方とは対照的です。また、IGBMCでは研究者、事務スタッフ、技術スタッフの関係性がフラットなので、研究の話はもちろん、プライベートの話などが大いに盛り上がることが印象的でした。」
さらに最近では、宮成准教授らは、がん化などにも関連するPMLボディの機能を明らかにするために、ALaP法を開発し、PMLボディによって遺伝子発現が制御されるメカニズムの一旦を明らかにした [5,6]。
ナノ生命科学研究所のテクノロジーとの融合により、数百もの蛋白質の挙動を見る。
この研究分野におけるチャレンジの一つは、単一遺伝子の発現プロセスに膨大な数のタンパク質が関与していることである。たとえば、単一の遺伝子を発現させるには100を超えるタンパク質が必要であるが、最先端のイメージング技術を使用しても、4つほどのタンパク質しか同時にイメージングできない。「遺伝子発現の制御メカニズムを完全に理解するには、ほんの一握りのタンパク質を識別して標識することができるだけでは不十分であることがわかりました」と宮成准教授は言う。「私のアプローチは、新しい技術を自分で開発することで、これまで不可能であった研究をすることです。たとえば、我々の開発したTGV法では、独自のタンパク質ラベル技術を用いることで、これまで全く明らかになっていないかったゲノムDNAの動態を明らかにすることができました。」
これまで、宮成准教授は蛍光顕微鏡とシーケンス技術をもとに研究を進めている。ナノ生命科学研究所では、他の研究者達と協力することで、AFMをベースとした技術の開発に取り組みむようだ。
「遺伝子発現の制御を理解することは、腫瘍発生、ウイルス感染、および発生学的障害などの遺伝子発現異常によって引き起こされる病気の原因究明に直結します。」
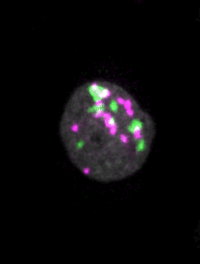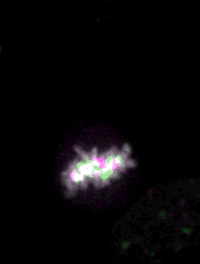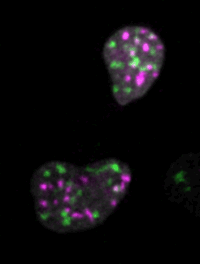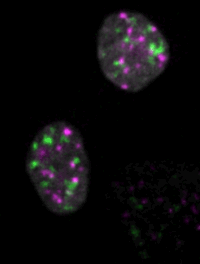
マウスES細胞のライブイメージングによって、細胞核のダイナミクスが細胞運命の決定にどのように寄与するかが見えてくる。
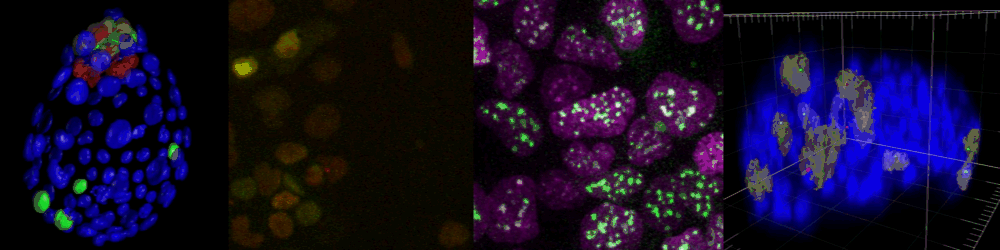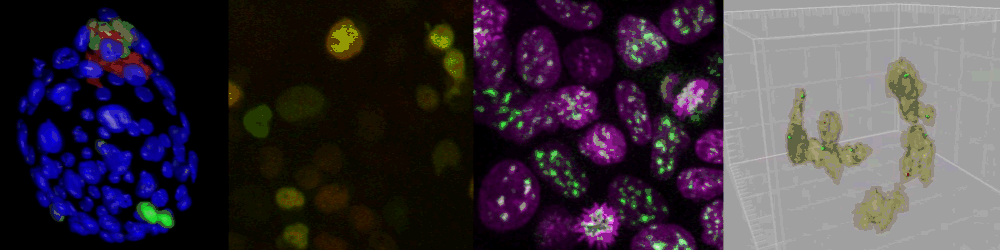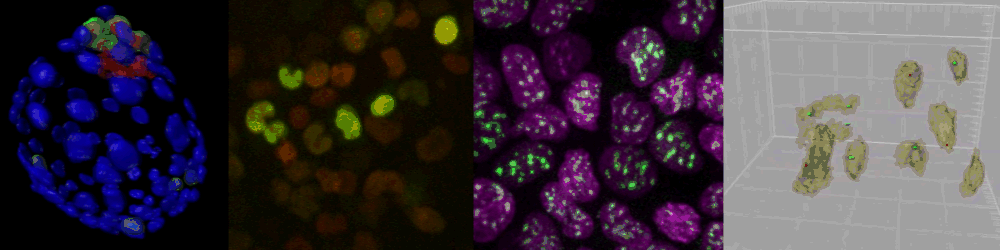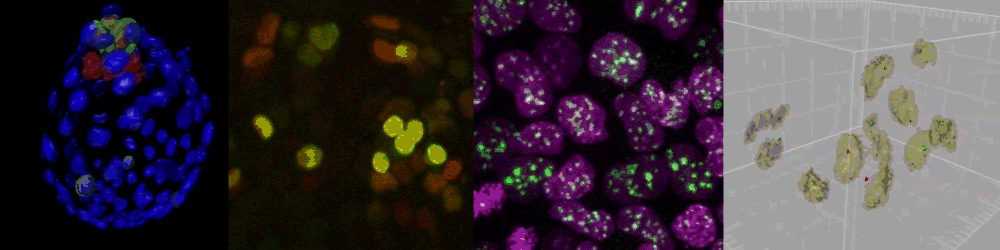
様々なイメージング技術を駆使することで研究をおこなっている。
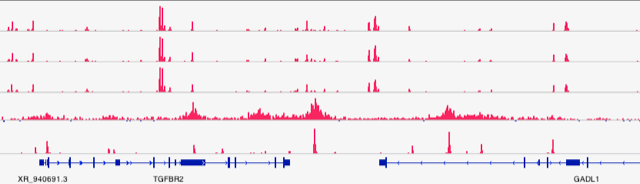
次世代シーケンス技術によって、クロマチン制御機構を分子レベルで理解することができる。
参考文献
[1] Yusuke Miyanari et al, The Lipid droplet is an organelle important for Hepatitis C virus production, Nature Cell Biology, 9, 1089–1097 (2007).
DOI: 10.1038/ncb1631
[2] Yufeng Li et al, Sequence-specific microscopic visualization of DNA methylation status at satellite repeats in individual cell nuclei and chromosomes, Nucleic Acids Res, 2013 Oct;41(19):e186.
DOI: 10.1093/nar/gkt766
[3] Yusuke Miyanari & Maria-Elena Torres-Padilla, Control of ground-state pluripotency by allelic regulation of Nanog, Nature 483, 470–473, (2012).
DOI:10.1038/nature10807
[4] Yusuke Miyanari, Live visualization of chromatin dynamics with fluorescent TALEs, Nature Structural & Molecular Biology, 20, 1321–1324, (2013).
DOI: 10.1038/nsmb.2680
[5] Misuzu Kurihara et al, Genomic Profiling by ALaP-Seq Reveals Transcriptional Regulation by PML Bodies through DNMT3A Exclusion, Molecular Cell, 78, 493-505.E8, 2020.
DOI: 10.1016/j.molcel.2020.04.004
[6] WPI-NanoLSI Press Release
Dock and Harbor: A Novel Mechanism for Controlling Genes
https://www.kanazawa-u.ac.jp/latest-research/79753
[7] Ishii S. et al, Genome-wide ATAC-see screening identifies TFDP1 as a modulator of global chromatin accessibility
Nature Genetics. 2024 Mar;56(3):473-482.
DOI: 10.1038/s41588-024-01658-1

