核膜孔複合体(NPC)の機能と構造ダイナミクス
核の門番として働くナノマシンの動態をリアルタイムで可視化する

Richard Wong, 金沢大学ナノ生命科学研究所 教授・主任研究者
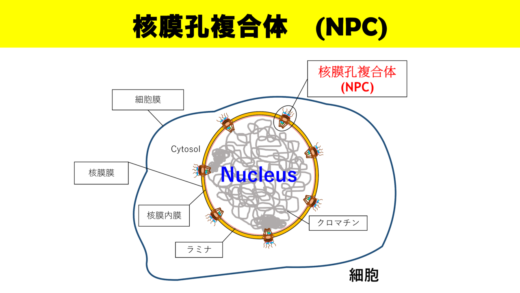
核―細胞質間の分子輸送を制御するナノマシン
核膜表面に存在する核膜孔複合体(Nuclear Pore Complex: NPC)は、細胞核と細胞質間の分子輸送を制御する重要な役割を果たしている。Richard Wong教授によると、「NPCはヌクレオポリンと呼ばれる約30種類のタンパク質からなる『ナノマシン』です。NPCはRNAやタンパク質のような分子を通行させる一方、病気や細胞死を引き起こす可能性がある分子の通行を阻止する門番として働きます。このように、NPCには重要な役割があるにもかかわらず、そのダイナミクスについてはほとんど分かっていません。ですから私は、世界的に有名な金沢大学の高速原子間力顕微鏡(高速AFM)技術を活用して、NPCのダイナミクスをリアルタイムで可視化したいと考えています」。
これまで、NPCの物理的特性は、電子顕微鏡による静的サンプルの観察によって研究されてきた。一方、Wong教授らは、NPCの機能と構造ダイナミクスを直接可視化しようと、金沢大学ナノ生命科学研究所で他の研究者らと協働している。「NPCは、感染やウイルス複製を阻止する、細胞内における最後の砦なのです」とWong教授は説明する。「私たちは、がん細胞のNPC内部にあるチャネルをイメージングしようとしています」。
走査型ナノプローブ技術でNPCの謎に迫る
Wong教授は、主にNPCの崩壊と形成や、核膜とNPC直下におけるヘモクロマチンの形成について研究している。この研究で使用されている機器は、超微細構造を観察する超高解像度光学顕微鏡や細胞構造を観察する共焦点顕微鏡、そして、タンパク質の動態を観察する高速原子間力顕微鏡(高速AFM)技術だ。Wong教授らは、高速AFMを用いて、ネイティブNPCの動態を可視化した。測定は、高速AFMをタッピングモードでカンチレバーを自由振動振幅2 nm、周波数900 kHz、毎秒200フレームで作動させて行われた。核膜表面と単一のNPCの動画では、孔が塞がったものと空いたものの両方が観察された。
さらにWong教授は、高速AFMにより大腸がん細胞核の表面に存在するNPCの動態を可視化することにも成功した [1]。具体的には、細胞質フィラメントによって囲まれゲートを構成するフェニルアラニン‐グリシン‐ヌクレオポリン(FG-Nups)の挙動を動画撮影したのである。動画からは、FG-Nups が「糸状、あるいは結節点から切れたクモの巣のような形状」をしていることが観察された。
「この構造を、私たちは『絡まったクモの巣の内部でスパイダーマンたちが働いている』様子と描写しています。これは、核膜孔による中央チャネル輸送もしくは遺伝子発現調節に関する、私たちのモデルです。これらの結果は、がん細胞を標的とするテーラーメイド型ドラッグデリバリーシステムの開発につながると期待されます」と、Wong教授は説明する。
今後は、タンパク質輸送のモデルを作るため、100 nmサイズの人工細孔の合成などを目指す。「簡単に言えば、タンパク質を細かくして、それを細胞の内側に入れ込むのです。実際はそんなに単純なことではないのですが、NPCの内部を観るのに極めて重要なのです」と、Wong教授は展望を語った。
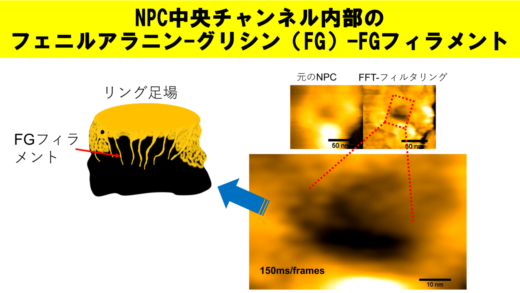

(左)NPC(オリジナル)
(右)FG-Nupsを高速フーリエ変換-バンドパスフィルター(特定の波長の光だけを効率よく透過するフィルター)を通してみたもの

150ms/frames
研究ハイライト
最近のナノポア核膜孔の関連研究論文としては、「高速原子間力顕微鏡法は,大腸がん細胞における死に至るコードとしての核膜孔の弾力性の喪失を明らかにする」(ACS Nano)[1] および「ROCKキナーゼによるNUP62分子のリン酸化修飾はp63の核内移行と扁平上皮癌の細胞増殖を制御する」 (EMBO Rep.) [2], 「カリオフェリン-αサブタイプの疾患特異的変化は、頭頸部扁平上皮癌におけるフィードフォワード発癌性シグナル伝達を確立する」(Oncogene) [3], 「ヌクレオポリンTPRのアップレギュレーションは、上衣腫におけるmTOR-HSF1トレイルを変化させ、オートファジー誘導を抑制する」(Autophagy) [4]などがあります。
参考文献
- MS Mohamed et al, “High-Speed Atomic Force Microscopy Reveals Loss of Nuclear Pore Resilience as a Dying Code in Colorectal Cancer Cells”, ACS Nano. 11, pp 5567–5578 (2017). doi: 10.1021/acsnano.7b00906.
- M Hazawa et al, “ROCK‐dependent phosphorylation of NUP62 regulates p63 nuclear transport and squamous cell carcinoma proliferation”, EMBO Rep. 19(1):73-88 (2018). doi: 10.15252/embr.201744523.
- Hazawa et al, “Disease-specific alteration of karyopherin-α subtype establishes feed-forward oncogenic signaling in head and neck squamous cell carcinoma”, Oncogene (2019). doi: 10.1038/s41388-019-1137-3. [Epub ahead of print]
- Dewi et al, “Nucleoporin translocated promoter region (TPR) upregulation alters mTOR-HSF1 trails and suppresses autophagy induction in ependymoma.”, Autophagy (2020) accepted

