分子生物学:ナンセンスを理解する
ナンセンスを介するmRNA分解の細胞品質管理メカニズムの解明と治療への応用の可能性

佐藤華江、金沢大学ナノ生命科学研究所 特任准教授
2022年9月、生化学、遺伝学、生細胞イメージングを専門とする佐藤華江准教授が、ナノ生命科学研究所に着任した。「私は、RNAとクロマチン生物学を専門としています。クロマチンとは、明確な核を持つ生物(いわゆる真核細胞)の細胞に見られるDNAとタンパク質の複合体です」と佐藤准教授は言う。「近年は、メッセンジャーRNA(mRNA)の分解経路、特に、ナンセンス変異依存性mRNA分解経路(Nonsense-Mediated mRNA decay: NMD)として知られる非常にエキサイティングな分野に焦点を当てています。」
ナンセンス変異依存性mRNA分解は、きわめて重要な「品質管理経路」であり、遺伝暗号の途中に挿入されてしまった異常な終止コドン(細胞内のタンパク質合成を停止するシグナルの引き金を引くmRNAの3つのヌクレオチド塩基の配列)を含むmRNAを検出して排除する機構である。この場合の翻訳とは、タンパク質合成の過程でmRNA分子のヌクレオチド塩基配列をアミノ酸配列に翻訳するプロセスを意味する。
遺伝学とライブセルイメージングを活用
「私の研究では、あらゆるバイオテクノロジーを用いて多角的にアプローチします。」と佐藤准教授は説明する。「特に、次世代シーケンシング(NGS)とライブセルイメージングを使用することで細胞集団から一細胞レベルでの検出を目指しています。イメージングでは、生きた細胞において単一分子のmRNAを捉えることができます。この方法ならば、生きた細胞での転写、mRNAの核外移送、翻訳、分解を含む遺伝子発現の過程において、mRNA分子の運動と局在を検出することができます。」
米国に移住して視野を広げ、新しいスキルとネットワーキングを学ぶ
佐藤准教授は、東京大学で学位を取得したあと米国に渡り、ロチェスター大学のリン・マクアット博士、アルバート・アインシュタイン医科大学のロバート・シンガー博士とジョン・グリーリー博士のアドバイスの下、RNAとクロマチン研究のスキルを磨いた。「米国のメンター達は、NMDとクロマチン研究の理解を深める上で中心的な役割を果たしました」と佐藤准教授は言う。「アメリカで研究する機会を得たことで、この研究分野についてさらに学ぶことができたばかりではなく、科学コミュニティ内の主要な関係者とネットワークを形成することができました。このようなネットワークは、国際的な研究を遂行する上で非常に重要です。」
NanoLSIにおける連携と、ナンセンス変異型遺伝子疾患への治療法の可能性
「転写やmRNAの翻訳、mRNAの局在を捉えるmRNA一分子イメージング技術は、NanoLSIで共同研究を立ち上げるのに最適な手法の一つだと思います」と佐藤准教授は語る。「ここで同僚達とこれからのプロジェクトについて話し合うのが楽しみです。」
佐藤准教授は、mRNAや遺伝子発現プロセスに関する知識を幅広く応用する可能性を模索しており、特にナンセンス変異型遺伝子疾患に対するRNA治療法の研究を拡大しようとしている。ナンセンス変異型遺伝子機能の回復を試みるRNA治療法(ナンセンス抑制療法)は、ナンセンス変異を原因とする遺伝子疾患の解決策を見つけるための戦略である。この戦略のための薬剤開発が試みられているが、NMDによるmRNAの減少が薬剤誘発性ナンセンス抑制を困難にしている。
「NMD阻害に対するナンセンス抑制の役割を明らかにすることで、完全長の機能性タンパク質の効率的な発現を目指し、ナンセンス抑制に関与する因子や経路を特定する計画です」と佐藤准教授は説明する。「ナンセンス変異を持つ疾患関連遺伝子を治療する薬物療法を開発し、社会に役立てたいと思っています。」
米国と日本の研究の比較
佐藤准教授は、日本とアメリカの大学で研究した経験がある。主な違いの一つは、研究者間の日常的なコミュニケーションだと言う。「米国では、主任研究員(PI)とポスドクまたは学生の間のコミュニケーションが日本よりもはるかに緊密です」と振り返る。「学生達は、たとえPIと意見が違っても、遠慮なく自分の意見を言います。PIはそれに耳を傾け、研究を進めます。このようにオープンな議論ができることは、米国と日本の研究アプローチの大きな違いの一つです。米国では、コミュニケーションを介して問題の解決策を見つけ、研究を前進させる方法を学びました。」佐藤准教授は、海外の著名な研究者との交流を促進させ、文化間の架け橋として役割を果たしたいと考えている。
科学における女性研究者
「日本では女性研究者が非常に少なく、政府は、より多くの女性が科学分野に進出するよう後押しをしています」と佐藤准教授は言う。「私は女性研究者として、多くの女性に科学分野でのキャリア、特に独立した研究者としてのキャリアを積極的に考えてもらうために、積極的な役割を担う必要があると感じています。育児と独立した研究者としての仕事を両立させてきた私の経験を共有することもできますしね。現在、私は研究室を立ち上げ、人材を募集しているところです。自分自身のチームで研究をスタートし、NanoLSIで米国での経験を共有できることに、非常にわくわくしています。」
研究ハイライト:シングルセルアッセイとクロマチン遺伝
佐藤研究室では現在もいくつかのプロジェクトを進めており、最近の成果としては、単一細胞におけるmRNA分解とNMD効率を評価する新たなシングルセルアッセイの確立などが挙げられる[1]。「このアッセイは、NMD研究におけるユニークなアプローチです」と佐藤准教授は言う。「これにより、細胞集団内のナンセンス変異依存性mRNA分解の細胞内変動を研究することができます。このアプローチにより、通常の生化学的アプローチでは検出できない希少ではあるが重要な細胞集団の研究が可能になるのです。」これらの研究結果は、NMDの効率は環境により変動し、かつ生理学的条件に依存することを示唆しており、NMDの回避をもたらす未知の調節経路の解明に繋がるものだ。
最近発表した、もう一つの注目すべき発見は、「広領域ヘテロクロマチンドメインへの細胞分裂後のマクロH2Aのリターゲティング」である[2]。
参考文献
- H. Sato, R.H Singer, Cellular variability of nonsense-mediated mRNA decay. Nature Communication 12, 7203 (2021).
https://doi.org/10.1038/s41467-021-27423-0 - H. Sato, B. Wu, F. Delahaye, R.H. Singer, J. M. Greally Retargeting of macroH2A following mitosis to cytogenetic-scale heterochromatic domains, J Cell Biol (2019) 218 (6): 1810–1823.
https://doi.org/10.1083/jcb.201811109

単一分子mRNAを検出するリアルタイムイメージング技術により、転写、翻訳、mRNAの局在などのmRNA制御における分子ダイナミクスが明らかとなる。
ER標的タンパク質をコードしたmRNAを蛍光タンパク質で標識し、リアルタイムイメージング。 翻訳中のER標的タンパク質をコードするmRNAは、翻訳に伴うトランスロケーションにより、小胞体(ER)に結合する。
非翻訳mRNAは焦点面以外へ自由拡散する。
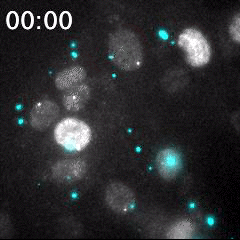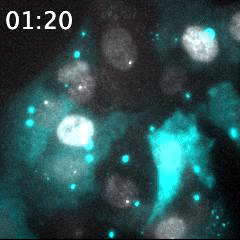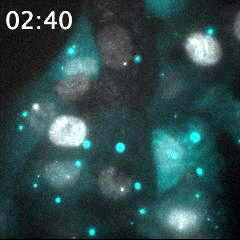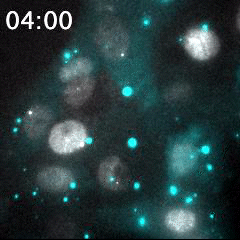
脂質ナノ粒子(LNP)を用いて送達された蛍光標識siRNA(シアン)と、核(灰色)内で転写中のmRNA(明るい灰色のスポット)の同時リアルタイムイメージング。細胞に送達される前のLNPは、明るい大きなシアン粒子として識別される。蛍光標識されたsiRNAが細胞質内に送り込まれることで、シアンの蛍光が細胞領域全体に広がる。このイメージング手法は、オリゴヌクレオチドを用いたドラッグデリバリーの評価に有用である。
Podcast




