液-液相分離がオートファジーを制御する仕組みを発見 ~オートファジー研究は次のフェーズへ~
- 細胞内でオートファジーを担う構造体の集まる仕組みや実体は長らく不明であった。
- 栄養飢餓になるとAtg13たんぱく質が脱リン酸化して他のAtgとともに液-液相分離した液滴を形成し、オートファジーの進行を担うことを明らかにした。
- 液-液相分離がオートファジーを直接制御しているという全く新しい機序の発見により、オートファジーを制御する新たな薬の開発に道が拓けることが期待される。
概要
JST 戦略的創造研究推進事業において、微生物化学研究所の野田 展生 部長、藤岡 優子 上級研究員らは、オートファジーの進行を担う構造体の実体が、Atgたんぱく質が液-液相分離(※1)した液体状の会合体(液滴(※2))であることを発見しました。
オートファジーは細胞内のたんぱく質を分解する仕組みの1つです。これまでに、Atgたんぱく質が集まってPAS(※3)と呼ばれる構造体を形成することが分かっていましたが、Atgたんぱく質が集まる仕組みや形成された構造体の状態はよく分かっていませんでした。
本研究グループは、Atg13たんぱく質の蛍光顕微鏡解析によりPASの性質を明らかにするとともに、試験管内でPASを再構成することに成功しました。そしてPASはAtg13が他のAtgたんぱく質とともに液-液相分離して形成された液滴の状態がその実体であり、この液滴がオートファジーを担うことを初めて明らかにしました。
液-液相分離がオートファジーを直接制御していることを明らかにした本研究の結果は、液-液相分離が細胞内の生命現象全般に広く関与していることを示唆しており、さまざまな細胞内現象について分子機構の見直しが進むことが期待されます。さらに、オートファジーが関係する病気に関して、液-液相分離の制御に着目したオートファジー特異的な制御剤の開発が期待されます。
本研究成果は、2020年2月5日(英国時間)に英国科学誌「Nature」のオンライン速報版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長)
研究課題名:「オートファジーの膜動態解明を志向した構造生命科学」
研究代表者:野田 展生(微生物化学研究会 微生物化学研究所 部長)
研究期間:平成25年4月~令和2年3月
研究の背景
オートファジーは酵母からヒトまで保存された細胞内の主要な分解経路であり、有害なたんぱく質凝集体や傷ついたミトコンドリアなどの分解を通して、細胞の恒常性維持に働いています。そしてオートファジーの異常は神経変性疾患やがんなど、重篤な疾病を引き起こすことが知られています。これは生体にとって極めて基本的かつ重要な現象であり、そのメカニズムを知ることは疾病の治療や予防法の開発のために欠かせません。
オートファジーでは、オートファゴソームと呼ばれる脂質膜の袋を新生し、分解対象を包んで分解の場であるリソソームへ輸送し、分解を行います。オートファゴソームの新生はオートファジーの最も重要な過程であり、約20種類のAtgたんぱく質が担っています。酵母を用いた解析により、栄養飢餓でオートファジーが誘導されると、Atgたんぱく質が液胞膜の近傍に集合してPASと呼ばれる構造体が形成され、オートファゴソームを形成します。しかしさまざまなたんぱく質が高濃度でひしめき合う細胞質内で、散在していたAtgたんぱく質がどのように速やかに集合し、形成されたPASはどのような実体で、どのようにしてオートファゴソームの形成を担うのかは全く分かっていませんでした。
液-液相分離は均質の溶液が2つ以上の液相に分離する現象で、私たちの身近でもしばしば観察されます。近年、細胞内で核酸やたんぱく質が液-液相分離を起こして周囲とは異なる液相を形成し、細胞内で球状の液滴を形成することが分かってきました。細胞の中には核やミトコンドリアなどの「膜で仕切られたオルガネラ」があることは古くから知られていますが、核酸やたんぱく質の液滴は「膜のないオルガネラ」として、さまざまな役割を担っていると考えられるようになってきました。
膜のないオルガネラは環境の変化に際して迅速に形成、解消することが可能であり、必要に応じて形成されるオルガネラとしてさまざまな役割を担っていると考えられています。しかし液-液相分離がオートファジーの制御に果たす役割はこれまで全く知られていませんでした。
研究の内容
本研究グループは、PASを構成するたんぱく質の1つであるAtg13に着目し、蛍光顕微鏡を用いて酵母細胞内での振る舞いを詳細に調べました。その結果Atg13は細胞質とPASの間を活発に往来しており、さらにPASの内部でも動き回っていることが分かりました。PASが形成される過程を詳細に観察した結果、まず複数の小さな球状構造が液胞膜上に形成され、それが膜上を動き回りながら互いに融合して1つのPASになることが分かりました。これらの特徴は、PASが液-液相分離で形成された液体状の液滴であることを示しています。
次にAtg13を構成因子として含むAtg1複合体の挙動を試験管内で調べました。精製したAtg1複合体は試験管内で速やかに球状の液滴を形成し、液滴同士は活発に融合するなどの性質を示しました。高速原子間力顕微鏡(※4)を用いた解析の結果、液滴ではAtgたんぱく質がランダムな配置で分布し、運動している様子が観察されたことから、液体様の構造であることが確かめられました。
栄養が豊富な環境にいる酵母ではAtg13はTORC1というリン酸化酵素によりリン酸化を受け、PASの形成を阻害し、酵母を栄養飢餓にさらすとAtg13がホスファターゼにより脱リン酸化を受け、PASの形成が促進されることが知られています。同様に試験管内においても、Atg13をTORC1によりリン酸化すると液滴形成が阻害され、ホスファターゼで脱リン酸化すると液滴形成が促進されました。この結果から、Atg13のリン酸化状態が液-液相分離の制御を通して、PASの形成とオートファジーの進行を制御していることが分かりました。
Atg1たんぱく質自体もリン酸化酵素であり、その活性化を通した他のAtgたんぱく質のリン酸化がオートファジーの進行に重要であることが分かっていました。今回の試験管内での解析の結果、Atg1複合体が液-液相分離し液滴を形成した場合のみ、Atg1の活性化が進行することが分かりました。Atg1の活性化を行うことが液滴を形成する意義の1つと考えられます。
酵母ではPASは常に液胞膜の上で形成されます。液胞膜に存在するVac8たんぱく質を欠損させたところ、PASが液胞膜から離れることが分かりました。さらに、試験管内でVac8たんぱく質を結合させた脂質膜にAtgたんぱく質液滴を添加すると、液滴が脂質膜に結合し、脂質膜上を動き回りながら互いに融合することが分かりました。これは酵母におけるPASの形成過程を再現していると考えられます。
これらの結果から、細胞が栄養飢餓を感知すると、Atgたんぱく質が液-液相分離を引き起こし液胞膜上に濃縮して、PASそのものである液滴を形成させ、オートファゴソーム形成に必要な因子の濃縮やAtg1の活性化を通してオートファゴソームの形成が進行することが明らかになりました。
今後の展開
オートファジーが液-液相分離で制御されており、PASの実体がAtgたんぱく質の液滴であることを明らかにしたことは、これまでのオートファジー制御の考え方を根底から変え得る成果です。これまでのオートファジーのメカニズム研究は個別のAtgたんぱく質の解析が中心でしたが、新たに液-液相分離の考え方を導入することで、Atgたんぱく質が「集団としてどのように振る舞うのか」という新しい切り口からの研究が展開され、極めて複雑なオートファジーの仕組みの解明が一挙に進むことが期待されます。また「相分離状態の制御」という全く新しい視点からのオートファジー制御剤の開発を進めることで、オートファジーが関連するさまざまな疾病の治療や予防法の開発研究が促進されると期待されます。
今回の発見は液-液相分離が細胞内現象全般の制御に深く関わることを強く示唆するものです。本研究では高速原子間力顕微鏡を活用することで液滴に含まれるたんぱく質の形状を観察することに成功し、液滴と脂質膜の間の相互作用を試験管内で再現するなど、新たな手法の開発を通して広く生命科学全般の発展にも貢献すると考えられます。
付記
本研究は、東京工業大学 大隅 良典 栄誉教授、金沢大学 安藤 敏夫 特任教授、理化学研究所 岡田 康志 チームリーダー、東京大学 鈴木 邦律 准教授らと共同で行いました。
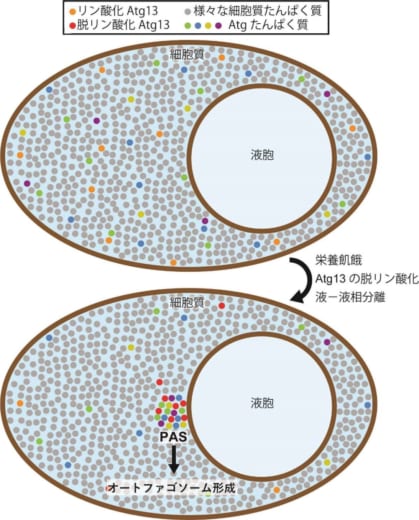
図1 液-液相分離によるPASの形成モデル
栄養豊富な条件では、Atgたんぱく質は細胞質中に分散しており、細胞質を満たしているさまざまなたんぱく質と混ざり合っている。栄養飢餓になりAtg13が脱リン酸化されると、Atg13は他のAtgたんぱく質とともに液-液相分離して液胞膜上に新たな液相(液滴)を形成する。この液滴がPASの実体であり、液滴からオートファゴソームの形成が進行する。
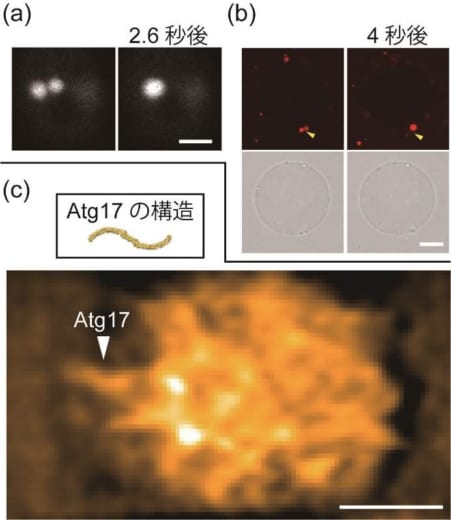
図2 PAS液滴の観察
(a)酵母細胞内でPAS同士が融合して球形になる様子。Atg13に融合させた蛍光たんぱく質の蛍光で観察した(スケールバー:2マイクロメートル)。
(b)巨大リポソーム膜上でAtgたんぱく質液滴が融合する様子。上の写真2枚はAtg13の蛍光像を、下の2枚は微分干渉像を示す(スケールバー:10マイクロメートル)。
(c)高速原子間力顕微鏡によるAtgたんぱく質液滴の観察結果。液滴にはAtg17がランダムな向きで存在している様子が分かる。画像はFFTバンドパスフィルター処理を行っている(スケールバー:100ナノメートル)。
用語解説
掲載論文情報
- 論文タイトル
- Phase separation organizes the site of autophagosome formation (相分離はオートファゴソーム形成の場を構築する)
- 著者
- Yuko Fujioka, Jahangir Md. Alam, Daisuke Noshiro, Kazunari Mouri, Toshio Ando, Yasushi Okada, Alexander I. May, Roland L. Knorr, Kuninori Suzuki, Yoshinori Ohsumi & Nobuo N. Noda
- 掲載誌
- Nature
- 掲載日
- 2020.02.05
- DOI
- 10.1038/s41586-020-1977-6
- URL
- https://doi.org/10.1038/s41586-020-1977-6

