酵母プリオンタンパク質のアミロイド線維形成を直接観察 -関連する病態の解明など多様な波及効果に期待-
- タンパク質異常のアミロイド線維は多くの病気に関係するが、仕組みが不明
- 出芽酵母のアミロイドタンパク質のアミロイド線維形成の観察に成功
- アミロイド線維が関わる病態の解明などさまざまな展開が期待される
概要
金沢大学ナノ生命科学研究所の紺野宏記准教授、中山隆宏准教授、安藤敏夫特任教授および東京工業大学 生命理工学院 生命理工学系の奥田桃子大学院生(研究当時博士後期課程3年)、田口英樹教授らの研究グループは、出芽酵母のプリオン(※1)タンパク質が多量体やアミロイド線維(※2)を形成する状況の観察に成功し、今まで不明だったアミロイド線維形成メカニズムの一端を解明することに成功した。
生命活動はタンパク質の機能によって成り立っている。タンパク質は特定の形を形成して働くのが基本だが、老化などの原因で異常な立体構造になることがある。異常構造の一つは「アミロイド」という線維状のタンパク質で多くの病気に関係することが分かっているが、どのような仕組みで線維ができていくのかについて、これまではよく分かっていなかった。
同グループは高速原子間力顕微鏡(高速AFM:※3)を用いて、出芽酵母のプリオンタンパク質がアミロイド線維を形成する状況を直接観察した結果、プリオンタンパク質の単量体が立体構造を取らない状態でアミロイド線維末端に結合してからアミロイド線維が伸びることを示唆する結果を得た。
この成果はアミロイド線維というタンパク質の異常状態ができるメカニズムの解明に貢献するとともに、クロイツフェルト・ヤコブ病(※4)や狂牛病といったプリオン病、アルツハイマー病などアミロイド線維が関わる病気に関する病態解明などさまざまな波及効果が期待できる。
研究成果は3月23日付の「米国科学アカデミー紀要」電子版に掲載された。
研究の背景
生命現象を担うタンパク質はアミノ酸が数珠状につながった鎖である。鎖が特定の形(立体構造)を形成して機能を発揮するのがタンパク質の基本だが、近年、立体構造を形成しない状態(天然変性状態:※5)のままでも機能する場合があること、いったん形成したタンパク質の立体構造がアミロイドという線維状の異常な凝集状態に変化する場合があることが分かってきた。
アミロイド線維はアルツハイマー病、クロイツフェルト・ヤコブ病や狂牛病などで知られるプリオンなどに代表される多くの神経変性疾患から見つかってきたが、病気に関係しないアミロイド線維も知られている。その一例が、酵母プリオンタンパク質が形成するアミロイド線維である。
パンやビールなどを作る際に使われる出芽酵母は生命科学研究のモデル生物の一つで多くの研究がなされている。出芽酵母の中にアミロイドを形成するタンパク質が10種類以上見つかっており、酵母プリオンタンパク質と呼ばれている。哺乳類よりも単純な単細胞生物でのプリオン研究はアミロイドやプリオンのよいモデルとしてこれまで多くの研究が進められてきたが、アミロイド線維がどのように伸びていくのかに関して詳細な分子機構は不明のままだった。
研究成果
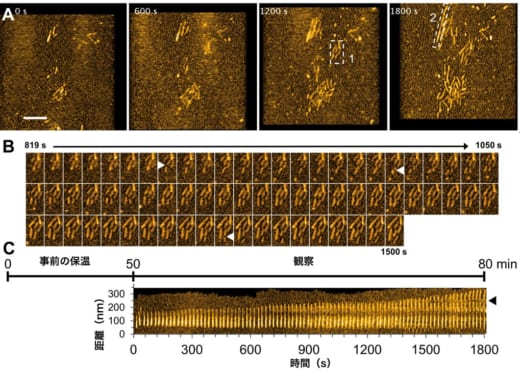
同研究グループは酵母プリオンタンパク質がどのようにアミロイド線維を形成するかを、代表的な酵母プリオンタンパク質である「Sup35」で研究した。線維形成の観察は高速原子間力顕微鏡(高速AFM)というタンパク質一個一個の動きを直接捉えることが可能な装置で行った。その結果、酵母プリオンタンパク質が形成する多量体の動態やアミロイド線維の伸長の様子を、0.05秒程度の時間分解能かつ0.1 nm(ナノメートル)程度の空間分解能で観察することに成功した(図1)。
図1. 酵母プリオンタンパク質が形成するアミロイド線維が伸びる様子の高速AFM観察
- 高速AFMで観察した酵母プリオンタンパク質Sup35のアミロイド伸長の様子。600秒おきに観察。
- Aの点線で囲った1の領域のみを抜き出して、より高い時間分解能で観察したスナップショット。白色の矢頭は線維が分断した部分を示す。
- Aの点線で囲った2の領域を抜き出して、時間ごとに並べた図。黒色の矢頭は線維が分断した部分を示す。
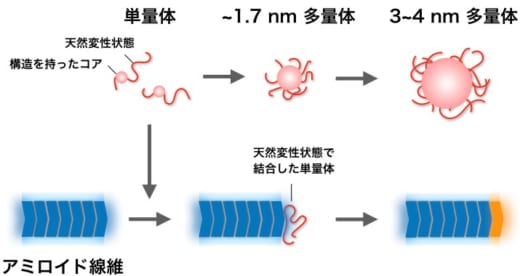
さらに、アミロイド線維が伸びる際に、立体構造を形成していない天然変性状態のタンパク質が線維末端に結合してからアミロイドになることを示唆する結果を得た。これらを総合して、酵母プリオンタンパク質がどのようなメカニズムで多量体やアミロイド線維を形成するのかについての新たなモデルを提案した(図2)。
図2. 酵母プリオンタンパク質が作る多量体とアミロイド線維の形成機構のモデル
単量体(赤)は直径約1.7 nmの多量体を経て直径約3~4 nmの多量体になる。その一方、単量体は天然変性状態でアミロイド線維(青)の末端に結合したのちに構造変換して線維の一部となり、線維が伸長する(オレンジ)。
今後の展開
アミロイド線維が関わる病気は先に挙げたアルツハイマー病やクロイツフェルト・ヤコブ病以外にも多岐にわたる。これらアミロイド線維が関わる病気についてこれまで多くの研究がなされてきたが、現状では根本的な治療薬がなかった。その理由の一つとして、アミロイド線維の形成機構がいまだに十分分かっていないことが挙げられる。
今回の研究は、アミロイド線維になる前のタンパク質がどのような状態にあるのかについての新たな知見を含んでいる。このため、アミロイド線維というタンパク質の異常状態が形成されるメカニズムの解明に貢献するとともに、クロイツフェルト・ヤコブ病や狂牛病といったプリオン病やアルツハイマー病などアミロイドが関わる病気に関する病態解明、さらには創薬などへの波及効果が期待できる。
プレスリリース本文はこちら
用語解説
掲載論文情報
- 論文タイトル
- Dynamics of oligomer and amyloid fibril formation by yeast prion Sup35 observed by high-speed atomic force microscopy (和訳:高速原子間力顕微鏡による酵母プリオンSup35が形成する多量体、アミロイド線維形成の動態)
- 著者
- Hiroki Konno†, Takahiro Watanabe-Nakayama†, Takayuki Uchihashi, Momoko Okuda, Liwen Zhu, Noriyuki Kodera, Yousuke Kikuchi, Toshio Ando and Hideki Taguchi
(†は共筆頭著者) - 掲載誌
- Proceedings of the National Academy of Sciences of United States of America
- 掲載日
- 2020.03.23
- DOI
- 10.1073/pnas.1916452117
- URL
- https://doi.org/10.1073/pnas.1916452117


哺乳類のプリオンは重篤な病気として知られているが、酵母のプリオンではアミロイド線維ができた細胞は、必ずしも病気になって死ぬわけではなく、生育環境によってはアミロイドを持たない細胞より生育が有利になる場合がある。そのため、酵母プリオンは遺伝子型によらない多様性獲得に役立っていると考えられている。