ナノスケールのpHセンサーを開発し,がん細胞表面のpHイメージングに成功!
- ナノスケールのpHセンサーを独自に開発し,胃酸放出細胞やがん細胞表面でのナノスケールのpHイメージングに成功。
- pH感受性の膜をナノスケールのガラスピペットに修飾したナノピペット型pHセンサーを独自開発し,pHeを単一細胞レベルかつ非標識でイメージングすることに成功。
- 本研究成果は,がんの診断および酸性環境の評価に役立つと期待される。
概要
金沢大学ナノ生命科学研究所のYuri Korchev教授,髙橋康史准教授,英国・インペリアル・カレッジ・ロンドンのYanjun Zhang博士,富山大学薬学部の酒井秀紀教授,藤井拓人助教の国際共同研究グループは,ナノスケールのpHセンサーを独自に開発し,胃酸放出細胞やがん細胞表面でのナノスケールのpHイメージングに成功しました。生体内の細胞は,細胞固有の細胞外微小環境(※1)に取り囲まれており,細胞が生きていく上では,この細胞外微小環境を中性に保つことが必要です。細胞内で腫瘍や炎症が生じると細胞外微小環境が酸性化するなど,pHの異常はさまざまな疾患につながることから,細胞外微小環境での細胞外pH(pHe)の測定は細胞の機能調整とpHの関係の理解につながります。しかし,これまで一般的に用いられているpHプローブでは,分解能や反応速度などの課題があり,pHeの定量化が困難でした。
本国際共同研究グループは,pH感受性の膜をナノスケールのガラスピペットに修飾したナノピペット型pHセンサーを独自開発し,pHeを単一細胞レベルかつ非標識でイメージングすることに成功しました。
本研究成果は,がんの診断および酸性環境の評価に役立つと期待されます。
本研究成果は,2019年12月6日10時(英国時間)に英国科学誌『Nature Communications』のオンライン版に掲載されました。
研究の背景
細胞が生きていく上で,細胞外微小環境を中性に保つことが必要です。しかし,腫瘍および炎症が生じると,嫌気的解糖(※2)によりpHが酸性化し,腫瘍転移の促進や,炎症反応が調節されます。このような細胞外微小環境でのpHeの測定は,細胞の機能調整とpHの関係を理解するために重要であり,がんの診断と治療にもつながります。しかし,現在最も一般的に使用されるpHプローブはガラス電極を用いるもので,センチメートルのスケールであり,かつ,応答が非常に遅いことが課題です。また,蛍光分子を用いるpHプローブは,生体の自家蛍光(バックグラウンド蛍光)のレベルが高く検出感度が低いことに加え,急速な光退色が生じるため,pHeの定量化が困難になります。
研究成果の概要
そこで,本国際共同研究グループは,pH感受性の膜をナノスケールのガラスピペットに修飾したナノピペット型pHセンサーを独自に開発し,pHeを単一細胞レベルかつ非標識でイメージングしました。pH感受性の膜は,ポリ-L-リジン/グルコースオキシダーゼ(PLL / GOx)の混合物をグルタルアルデヒドで架橋することで形成しました(図1)。この膜は,PLLの正に帯電した第4級アミンと,GOxの負に帯電したカルボン酸残基により,双性イオンポリマー膜として振る舞い,pHに依存して電荷が効率的に変化します(図2)。この電荷の変化に依存してナノピペット型pHセンサーで計測される電流や電位が変化することで,この変化からpHを計測することができます。開発したナノピペット型pHセンサーは,2 ミリ秒の応答時間,50 ナノメートルの空間分解能,pHを0.01 ユニットの感度で計測できる世界最速の応答速度を示しました(図3)。そこで,このナノピペット型pHセンサーを試料近傍に配置して,pHe計測を行ったところ,胃酸を放出する壁細胞からの胃酸放出の計測や,藻類の光合成や呼吸に伴うpHeの変化を計測することに成功しました(図4(a, b))。さらに,このナノピペット型pHセンサーは,pHeを計測するだけでなく,走査型イオンコンダクタンス顕微鏡(SICM)(※3)の計測原理を適用することで,細胞表面の形状を超解像度レベルで同時に取得することが可能です。実際に,がん細胞表面のpHeプロファイルを3次元的に可視化することに成功しました(図4(c))。
今後の展開
細胞外酸性pHは,がん細胞の浸潤と移動を促進し,治療の障壁となっています。開発したナノピペット型pHセンサーをSICMに応用したSICM-pHナノピペットセンサ―技術により,単一細胞レベルでpHeの3Dマッピングが可能になります。これにより,がんの診断の新たな技術となるだけでなく,細胞外酸性化速度の評価に貢献することが期待されます。
本研究は,文部科学省「世界トップレベル研究拠点プログラム」(WPI),国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「統合1細胞解析のための革新的技術基盤」研究領域における「ケミカルマッピングを実現するナノ電気化学顕微鏡の創成」(研究代表者:髙橋康史),日本学術振興会科学研究費助成事業などの支援を受けて実施されました。
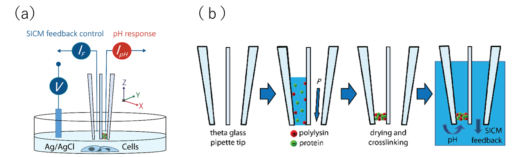
図1. (a)pHeと細胞表面形状の同時イメージング技術の概要と,(b)プローブの作製方法
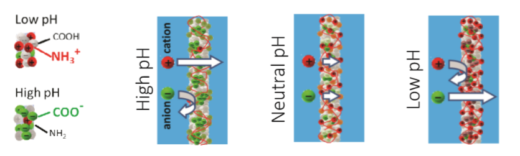
図2. pHeの計測原理の概要
pHに依存して,双性イオンポリマー膜(PLLとGOxの混合ポリマー)の電荷が効率的に変化する。この電荷の変化に依存してイオンの透過性が変化するため,イオン電流の値からpHを計測することができる。
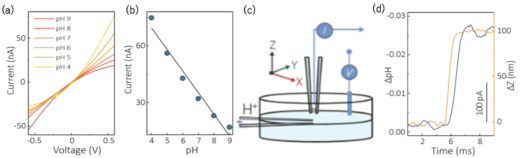
図3. ナノピペット型pHセンサーの応答特性
(a)pHに依存して,電圧電流特性が変化している。(b)+0.5 Vに電圧を維持した際の応答。(c)ナノピペット型pHセンサーの応答速度評価の概要。ナノピペット型pHセンサーの近傍にプロトン供給用のピペットを配置し,プロトン供給用のピペット近傍に形成された定常状態のpH勾配を利用して,ナノピペット型pHセンサーとプロトン供給用のピペットとの距離を調整することで,応答時間を評価している。(d)応答時間の評価。オレンジ色が高さ方向のセンサーの位置,青がpHの応答。2 ミリ秒(ms)以内に定常に達していることが確認できます。
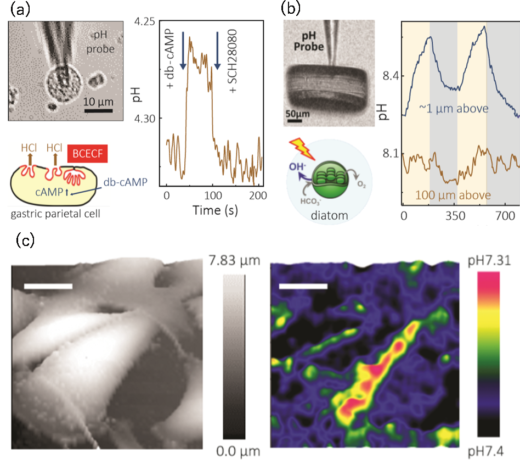
図4. ナノピペット型pHセンサーによるpHe計測およびイメージング
(a)胃酸を放出する壁細胞の胃酸放出の計測。ナノピペット型pHセンサーを壁細胞に近接させ,100 µM db-cAMP により細胞を刺激することで,胃酸放出に伴うpH変化が計測できた。さらに,K+-ATPase阻害剤(胃酸放出を抑える)であるSCH28080を加えることで応答が元に戻る様子を確認できた。
(b)珪藻に光を照射した際に生じるpHeの計測。外部からの光の照射のon/offに対応したpHeの変化を計測することができた。
(c)メラノーマ細胞の(左)形状と(右)pHeイメージ。細胞の不均一性に依存して,細胞表面のpHeにも違いがあることがイメージングにより明らかとなった。スケールバーは,20 μm。
用語解説
掲載論文情報
- 論文タイトル
- High-resolution label-free 3D mapping of extracellular pH of single living cells
(単一細胞外pHの非標識高解像イメージング) - 著者
- Yanjun Zhang, Yasufumi Takahashi, Sung Pil Hong, Fengjie Liu, Joanna Bednarska, Philip S Goff, Pavel Novak, Andrew Shevchuk, Sahana Gopal, Iros Barozzi, Luca Magnani, Hideki Sakai, Yoshimoto Suguru, Takuto Fujii, Alexander Erofeev, Peter Gorelkin, Alexander Majouga, Dominik J Weiss, Christopher Edwards, Aleksandar P Ivanov, David Klenerman, Elena V Sviderskaya, Joshua B Edel, Yuri Korchev
- 掲載誌
- Nature Communications
- 掲載日
- 2019.12.06
- DOI
- 10.1038/s41467-019-13535-1
- URL
- https://doi.org/10.1038/s41467-019-13535-1

