サソリ毒ペプチドが効率的にK⁺チャネルを阻害する仕組みを世界で初めて解明!
- サソリ毒ペプチドが効率的にカリウムイオン(K+)チャネル(※1)を阻害する仕組みを高速原子間力顕微鏡(HS-AFM)(※2)を用いて世界で初めて明らかにした。
- 将来,さまざまな結合物質とチャネルの結合動態の解明に活用されることが期待される。
概要
金沢大学ナノ生命科学研究所/新学術創成研究機構の角野歩助教,炭竈享司博士研究員らの研究グループは,名古屋大学および自然科学研究機構生命創成探究センターの 内橋貴之教授ならびに福井大学の老木成稔教授と共同で,サソリ毒ペプチドが効率的にカリウムイオン(K+)チャネル(※1)を阻害する仕組みを高速原子間力顕微鏡(HS-AFM)(※2)を用いて世界で初めて明らかにしました。
我々の体を構成する細胞の細胞膜には,イオンチャネルという膜内外のイオン輸送を制御するタンパク質が組み込まれています。このイオンチャネルがさまざまな刺激に応答して特定のイオンを透過させる働きによって,細胞は電気信号を操り,我々は体を動かしたり,物事を考えたりすることができます。サソリの毒液に含まれるアジトキシン-2(AgTx2)というペプチド(※3)は,K+チャネルに結合してイオンの通り道をふさぐことでK+の透過を阻害してしまうことが分かっていましたが,その結合ダイナミクスの詳細は明らかにされていませんでした。
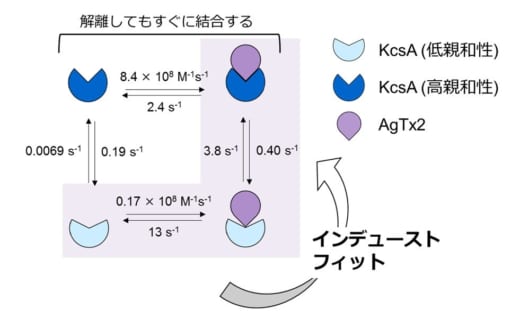
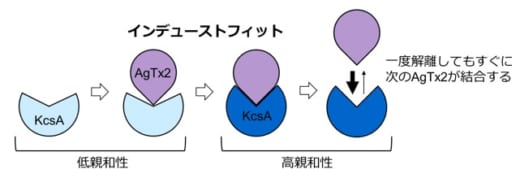
本共同研究グループは,HS-AFMを使ってAgTx2がK+チャネルに結合・解離する様子を直接観察し,そのダイナミクスを詳細に解析しました。その結果,AgTx2がK+チャネルに結合することでK+チャネルの構造がAgTx2に結合しやすい構造に変化し,一旦AgTx2が解離しても,すぐに次のAgTx2が結合するというインデューストフィット機構(※4)が使われていることが分かりました。さらに,詳細な反応速度の解析をした結果,インデューストフィットによってAgTx2のK+チャネルへの結合が400倍加速されることが明らかになり,AgTx2が効率的にK+チャネルの機能を阻害する仕組みを解明しました。
これらの知見は,将来,さまざまな結合物質とチャネルの結合動態の解明に活用されることが期待されます。
本研究成果は,2019年7月3日(米国東部標準時間)に米国科学誌「Science Advances」に掲載されました。
研究の背景
細胞膜には,イオンチャネルという膜内外のイオン輸送を制御するタンパク質が組み込まれています。このイオンチャネルがさまざまな刺激に応答して特定のイオンを透過させる働きによって,細胞は電気信号を操り,我々は体を動かしたり,物事を考えたりしています。イオンチャネルの働きの異常は心筋梗塞やてんかんなど多くの病気の原因になることから,イオンチャネルの働きを阻害する分子の動作機構を理解することが重要です。
サソリの毒液にはK+チャネルに対する結合物質が200種類以上発見されており,その中のAgTx2という分子はK+チャネルの強力な阻害分子です。AgTx2は38個のアミノ酸からなるペプチドで,K+チャネルの細胞外表面に結合してイオンの通り道をふさぐことで,K+イオン透過を阻害してしまうことが先行研究によって分かっています。しかし,その結合ダイナミクスが結合と解離の単純な2状態で説明できるのかどうかといった詳細なメカニズムは明らかにされていませんでした。
研究成果の概要
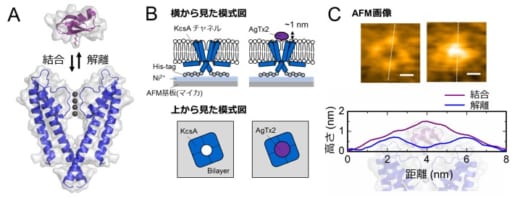
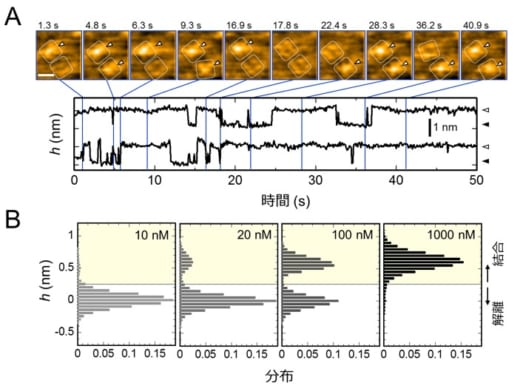
本共同研究グループは,HS-AFMを使ってAgTx2がK+チャネルKcsA(※5)に結合・解離する様子を直接可視化し,そのダイナミクスを詳細に解析しました(図1)。KcsAは4つの粒子が環状に四角に並ぶ4量体を形成します。この表面にAgTx2が結合すると,イオンの通り道となるチャネルの中心部がAgTx2の結合によって膨らんで見えます。K+チャネルへのAgTx2の結合と解離は繰り返し起こり,それに伴ってチャネル中心付近の高さも変化しました(図2)。また,溶液中のAgTx2の濃度が高くなると,結合した状態をとる確率も上がりました。結合・解離の時間変化を詳細に解析すると,AgTx2がKcsAに結合することでKcsAの構造がAgTx2に結合しやすい構造に変化し,一旦AgTx2が解離してもすぐに次のAgTx2が結合するというインデューストフィット機構が使われていることが分かりました。一方,AgTx2が解離してから時間が経つと,KcsAの構造がAgTx2が比較的結合しにくい状態へ変化することも観察されました。これらの観測結果は,結合ダイナミクスが単純な結合・解離の2状態で説明することはできないことを示しています。AgTx2結合時および解離時それぞれにおいて,AgTx2との親和性の異なるKcsAの状態が少なくとも2つずつ存在することから,4状態の結合モデルが考えられました(図3)。そこで,この4状態モデルを仮定して反応速度を計算すると,得られた速度定数は実験結果を実に良く再現しました。この4状態モデルと速度定数を使って結合ダイナミクスをシミュレーションすると,AgTx2結合はインデューストフィット経路を主に使用しており,インデューストフィットによってAgTx2の結合が400倍加速することが明らかになりました。以上より,AgTx2が効率的にKcsAの機能を阻害する仕組みを明らかにしました(図4)。
今後の展開
本研究で用いたチャネルとペプチドの結合のHS-AFM観察技術と解析手法は,チャネルに限らずあらゆる生体分子に応用することができます。例えば,受容体と結合物質,DNAとDNA関連タンパク質などの組み合わせにも適用可能です。本研究により,さまざまな生体分子の結合ダイナミクスの解明が加速することが期待されます。
本研究は,科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域における「原子間力顕微鏡を駆使した膜中イオンチャネル集団動作機構の革新的理解」(研究代表者:角野歩), 日本学術振興会科学研究費助成事業(若手研究(A), 挑戦的研究(萌芽), 若手研究(B), 新学術領域研究(動的秩序と機能), 基盤研究(B))による研究資金の支援および分子科学研究所の計算機センターの支援を受けて実施されました。
図1.K+チャネルKcsA(Q58A/T61S/R64D)とAgTx2の結合・解離の模式図と代表的なAFM像
A. KcsAとAgTx2の結合の模式図
B. AFM観察試料の模式図
C. 代表的なAFM像と白破線に対応する断面高さプロファイル。スケールバーは2 nm。
図2.K+チャネルKcsAにAgTx2が繰り返し結合する様子と結合確率のAgTx2濃度依存性
A. AgTx2の結合・解離を捉えたHS-AFM動画のスナップショットと,チャネル中心付近の平均高さ(h)の時間変化。HS-AFM画像中のスケールバーは5 nm。
B. 観察溶液中のAgTx2濃度に依存したhの分布の変化
図3.AgTx2とK+チャネルKcsAの結合動態モデルと速度定数
図4.AgTx2はインデューストフィットによって効率的にK+チャネルKcsAに結合する
用語解説
掲載論文情報
- 論文タイトル
- High-speed AFM reveals accelerated binding of Agitoxin-2 to K+ channel by Induced-fit
(インデューストフィットがK+チャネルに対するアジトキシン-2の結合を加速する) - 著者
- Ayumi Sumino, Takashi Sumikama, Takayuki Uchihashi, Shigetoshi Oiki
(角野歩,炭竈享司,内橋貴之,老木成稔) - 掲載誌
- Science Advances
- 掲載日
- 2019.07.03
- DOI
- 10.1126/sciadv.aax0495
- URL
- http://doi.org/10.1126/sciadv.aax0495