肺がん細胞が分子標的薬へ耐性化する仕組みを解明!
- ALK肺がん(※1)において分子標的薬(※2)にさらされた肺がん細胞が遺伝子変異および上皮間葉転換(※3)を起こすことで,薬剤に対して耐性を獲得することを初めて明らかにした。
- 動物実験でHDAC 阻害薬(※4)で治療した後に分子標的薬を投与することで,腫瘍細胞を間葉系から上皮系へと戻し,分子標的薬への耐性を克服することに成功した。
- 本研究は,分子標的薬の効果が得られなくなった ALK 肺がん患者の治療法の確立につながるものと期待される。
概要
金沢大学がん進展制御研究所/ナノ生命科学研究所の矢野聖二教授,福田康二助教,附属病院がんセンター/ナノ生命科学研究所の竹内伸司講師らの共同研究グループは,日本人の非小細胞肺がん患者の5%程度を占めるALK肺がん(※1)において分子標的薬(※2)にさらされた肺がん細胞が遺伝子変異および上皮間葉転換(※3)を起こすことで,薬剤に対して耐性を獲得することを初めて明らかにしました。
がんの分子標的薬は,効果があった場合でも腫瘍の一部が薬剤に対して耐性化することで薬剤の効力が失われ,再発することが問題でした。特に,細胞が形質転換する上皮間葉転換は,がんの浸潤や転移と密接な関係があることから,これに起因する薬剤耐性獲得メカニズムを明らかにすることは,がん治療法の発展に重要です。
本研究グループは,ALK 肺がんにおいて,分子標的薬にさらされた腫瘍細胞が,腫瘍細胞の遺伝子変異と,腫瘍細胞が上皮系から間葉系へと変化する上皮間葉転換の 2 つの異なるメカニズムによって薬に耐性化することを解明しました。さらに,動物実験においてHDAC 阻害薬(※4)で治療した後に分子標的薬を投与することで,腫瘍細胞を間葉系から上皮系へと戻し,分子標的薬への耐性を克服することに成功しました。
本研究成果は,分子標的薬の効果が得られなくなった ALK 肺がん患者の治療法の確立につながるものと期待されます。
本研究成果は,2019年2月8日(米国東部標準時間)に米国科学誌「Cancer Research」のオンライン版に掲載されました。
研究の背景
がんの分子標的薬は,高い確率で奏効するものの,腫瘍が薬に耐性を獲得して再発することが問題でした(図1)。その原因として,分子標的薬が結合するがん細胞内の分子に遺伝子変異が起こり,結合部位の構造が変化することで,耐性化することが広く知られています。また最近では,遺伝子変異以外の新たな耐性獲得のメカニズムとして,上皮間葉転換の関与が疑われています。しかし,上皮間葉転換と薬剤耐性との詳しい関連性は分かっておらず,その克服治療法はいまだ確立されていません。
研究成果の概要
本研究では,まず,分子標的薬に耐性化したALK肺がん患者の腫瘍組織を解析しました。その結果,腫瘍組織内で遺伝子変異が起こっている領域と,上皮間葉転換が起こっている領域の両方が独立して存在することを発見しました。この結果から,遺伝子変異と上皮間葉転換のそれぞれが,分子標的薬に対する耐性の原因になっていると考えられました(図2)。
遺伝子変異を克服するための次世代分子標的薬はすでに臨床で使用されていますが,上皮間葉転換による耐性は治療法がありません。そこで,がん細胞が上皮間葉転換を引き起こすメカニズムを調べました。その結果,がん細胞は遺伝子発現を制御するマイクロRNAのうちmiR-200cの発現を低下させることで,上皮間葉転換誘導転写因子であるZEB1の上昇および細胞接着因子であるE-cadherinの低下を誘導し, 上皮系から間葉系へと形質を変化させることで, 分子標的薬へ耐性化していることを突き止めました。
次に,間葉系のがん細胞を上皮系へと状態を戻すことで,その耐性を克服できるのではないかと考え,miR-200cの発現を上げることのできる薬剤の探索を行いました。その結果,HDAC(ヒストン脱アセチル化酵素)阻害薬の一種であるキジノスタットで治療することで,間葉系のがん細胞を上皮系へと戻し,分子標的薬へ感受化させることに成功しました(図3)。
さらに,動物実験において,キジノスタットで治療した後に分子標的薬で治療することで,がん細胞の分子標的薬への耐性化を著明に抑えられることを発見しました。
以上の結果から,HDAC阻害薬と次世代分子標的薬の逐次的な治療により,遺伝子変異と上皮間葉転換によるALK肺がんの分子標的薬耐性を克服できる可能性が明らかになりました(図4)。
今後の展開
本研究成果により,分子標的薬へ耐性化し,上皮間葉転換が確認された患者に,HDAC阻害薬と次世代分子標的薬で連続的に治療することで,その耐性を解除し,がんの根治あるいは再発までの期間を著明に延ばせることが期待されます。
今後は,効果や副作用の面から最適なHDAC阻害薬を選び出し,次世代分子標的薬と併用する臨床試験を行いたいと考えています。
本研究は,日本学術振興会科学研究費助成事業「ALK肺癌のEMTに起因するALK-TKI 耐性克服治療の開発」(研究代表者 福田康二,16K19447)および「miR-200sを標的とした肺癌のEMTに起因するTKI耐性克服治療の開発」(研究代表者 福田康二,18K07261)の支援を受けて実施されました。
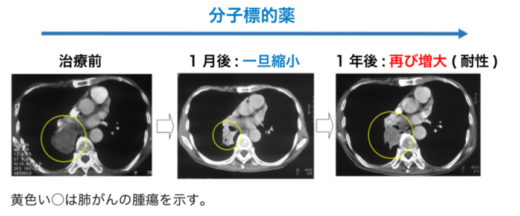
【図1】分子標的薬は一旦効くが,腫瘍の一部が残存し再発の原因になる
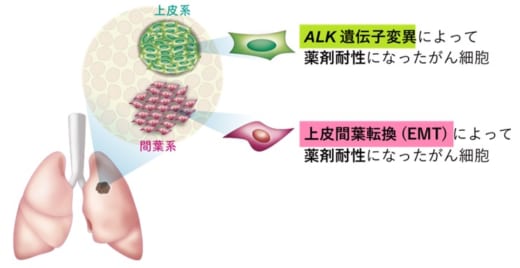
【図2】分子標的薬に耐性になったALK肺がん患者の腫瘍組織において,ALK遺伝子変異による耐性部位と,上皮間葉転換による耐性部位がそれぞれ存在する。
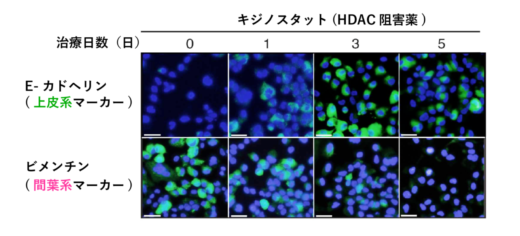
【図3】分子標的薬に耐性になったALK肺がん細胞において,キジノスタットで治療することで上皮系の回復を確認した。(上皮系マーカーが上昇,間葉系マーカーが低下)
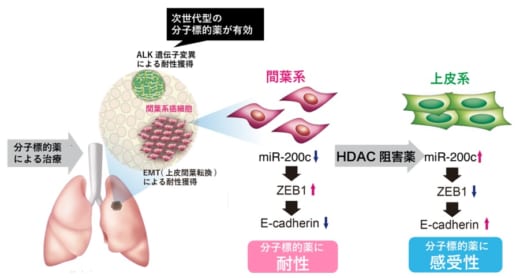
【図4】HDAC阻害薬で治療すると,miR-200cの発現上昇により間葉系のがん細胞は上皮系へと戻り,分子標的薬へ感受化できる。
用語解説
掲載論文情報
- 論文タイトル
- Epithelial-to-mesenchymal transition is a mechanism of ALK inhibitor resistance in lung cancer independent of ALK mutation status (肺がんにおいて,上皮間葉転換はALK変異とは独立したALK阻害薬耐性のメカニズムとして機能する)
- 著者
- Koji Fukuda, Shinji Takeuchi, Sachiko Arai, Ryohei Katayama, Shigeki Nanjo, Azusa Tanimoto, Akihiro Nishiyama, Takayuki Nakagawa, Hirokazu Taniguchi, Takeshi Suzuki, Tadaaki Yamada, Hiroshi Nishihara, Hironori Ninomiya, Yuichi Ishikawa, Satoko Baba, Kengo Takeuchi, Atsushi Horiike, Noriko Yanagitani, Makoto Nishio, and Seiji Yano
(福田康二,竹内伸司,新井祥子,片山量平,南條成輝,谷本梓,西山明宏,中川貴之,谷口寛和,鈴木健之,山田忠明,西原広史,二宮浩範,石川雄一,馬場智子,竹内賢吾,堀池篤,柳谷典子,西尾誠人,矢野聖二) - 掲載誌
- Cancer Research
- 掲載日
- 2019.02.08
- DOI
- 10.1158/0008-5472.CAN-18-2052
- URL
- http://cancerres.aacrjournals.org/content/early/2019/02/08/0008-5472.CAN-18-2052

