蛍光型と酵素型の間で可逆的に「変身」する シーソータンパク質を設計
-複数の機能をオン・オフできる人工タンパク質の創製に期待-
概要
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の紺野宏記准教授、理工学域生命理工学類生物科学コースの山本颯馬学部生、大学院自然科学研究科生命理工学専攻博士前期課程の山田竜生大学院生の研究グループは、東京科学大学(Science Tokyo) 生命理工学院 生命理工学系の池田刀麻大学院生、総合研究院細胞制御工学研究センターの野島達也研究員、田口英樹教授の研究グループとの共同研究により、機能が異なる2種類の立体構造に「変身」できるタンパク質を設計し、その変身過程の観察に成功しました。
古典的な考え方では、タンパク質はエネルギー的に安定な一つの立体構造に自ら折りたたまれます。しかし自然界には、2種類以上の立体構造に折りたたまれ、立体構造に応じて機能を切り替える変身タンパク質(※1)が存在します。タンパク質工学分野ではこれまでにも、変身タンパク質が設計されてきましたが、異なる機能や構造を併せ持つタンパク質は実現していませんでした。
研究グループは、蛍光タンパク質(緑色蛍光タンパク質、GFP(※2))と酵素活性を持つタンパク質(ジヒドロ葉酸還元酵素、DHFR(※3))という二つのタンパク質を融合させることで、相互に変換できる2種類の機能性構造を持つタンパク質を設計し、「シーソータンパク質」と名付けました。GFP蛍光・酵素活性測定および構造解析により、このシーソータンパク質が実際に蛍光型と酵素型の2種類の立体構造をとることが確認されました。この2種類の立体構造の比率は、アミノ酸の変異やリガンド(※4)の存在、溶液条件(pH、塩濃度)によって可逆的に変化させることが可能です。さらに劇的な変身を、高速原子間力顕微鏡(HS-AFM(※5))によって直接可視化できました。
この成果は、複数の機能を切り替える人工タンパク質を創製するための新たな方向性を提供します。また環境応答型のバイオセンサーや特定の条件下でのみ活性化する酵素の設計などへの応用が期待されます。
研究成果は2月10日付の米国の学術誌「Proceedings of National Academy of Sciences of United States of America(米国科学アカデミー紀要)」電子版に掲載されました。
ポイント
○機能と構造が異なるタンパク質を融合させて、2種類の立体構造を持つ「シーソータンパク質」を設計。
○蛍光型と酵素型の2種類の立体構造を生化学的解析で確認し、構造変換過程を高速原子間力顕微鏡で観察することに成功。
○複数の機能をON/OFFできるタンパク質の設計に対する指針を提供。
研究の背景
タンパク質は、細胞内での代謝反応や細胞の形成などに関わる、生命活動に不可欠な物質です。タンパク質の機能が発揮されるには、20種類のアミノ酸が直鎖状につながったヒモ状の分子が最小の自由エネルギーを持つ正しい立体構造(天然構造)に折りたたまれる、フォールディングという過程を経る必要があります。このフォールディングについてはこれまで、1960年代の古典的な研究に基づいて、「タンパク質の立体構造はアミノ酸配列によって一意に定まる」という基本原理(アンフィンゼンのドグマ)が一般的に受け入れられてきました。すなわち、アミノ酸配列と立体構造は1:1の対応関係にあるということです。
しかし近年、この基本原理に当てはまらないタンパク質が見つかっています。例えば、環境(温度、pH、結合する分子等)によって構造と機能が可逆的に変化する「変身タンパク質」など、一つの配列に対して複数の立体構造が対応する例が報告されています。これまでに、変身タンパク質は自然界には100種類ほど存在すると報告されており、タンパク質全体の最大4%ほどがこのような性質を持つと推定されています。
このような自然界に存在する変身タンパク質を超えて、立体構造変換による機能制御の解明と応用を目指した、人工変身タンパク質設計の取り組みも進められてきました。これまでの研究では、複数種類の構造を持つタンパク質の設計やその制御には成功していましたが、それぞれに異なる機能を備えた2種類の構造を持つ変身タンパク質の設計やその構造変化を1分子レベルで解析することはできていませんでした。
研究成果
本研究では、蛍光性のタンパク質(緑色蛍光タンパク質GFP)と酵素活性を持つタンパク質(ジヒドロ葉酸還元酵素、DHFR)のそれぞれの末端領域を重ね合わせる融合方法によって、シーソータンパク質を設計しました(図1)。重ね合わせた領域(重複領域)はGFP領域とDHFR領域のどちらとも相互作用できますが、どちらか一方しか補完することができません。その排他的な相互作用によって、シーソータンパク質は構造的にも機能的にも異なる二つの状態(蛍光性のGFP型と酵素型のDHFR型)を持つと期待されました。
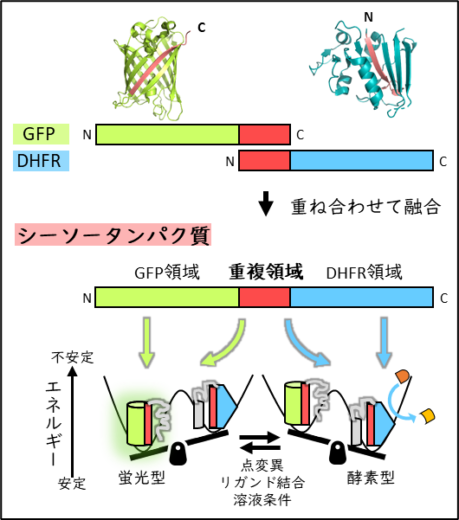 図1 シーソータンパク質の概要
図1 シーソータンパク質の概要
蛍光・酵素活性測定や高速原子間力顕微鏡(HS-AFM)観察を用いた構造解析を実施したところ、シーソータンパク質は実際に2種類の異なる機能性構造を持つタンパク質であることが分かりました(図2)。そしてその2種類の立体構造の比率(シーソーのバランス)をアミノ酸の変異やリガンドの存在、溶液条件(pH、塩濃度)によって制御できることが確認されました。さらに高速原子間力顕微鏡を用いることで、シーソータンパク質が劇的に変身する過程の観察にも成功しました。
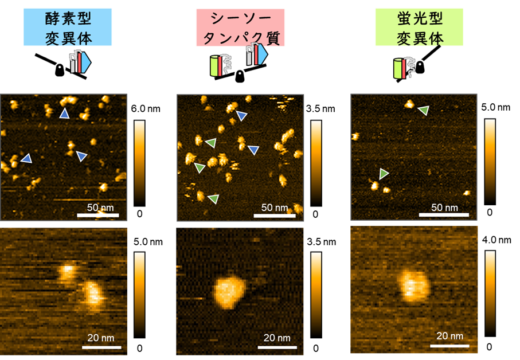
図2 高速原子間力顕微鏡(HS-AFM)によるシーソータンパク質の観察。シーソータンパク質は一つの球からなる蛍光型(緑矢印)と、二つのつながった球からなる酵素型(青矢印)として観察された。
社会的インパクト
本研究で設計されたシーソータンパク質は、これまで自然界に限られていた立体構造によって機能が切り替わる変身タンパク質を人工的に再現し、制御する新たな可能性を示しました。変身タンパク質は、生体内のさまざまな環境変化(pH、イオン濃度、リガンド結合など)に応じて機能を変える特性を持つことから、環境応答型のバイオセンサーや、特定の条件下でのみ活性化する酵素の設計など、新しいコンセプトのバイオテクノロジー応用へとつながる可能性があります。
また、本研究で用いた高速原子間力顕微鏡(HS-AFM)による直接観察は、シーソータンパク質だけでなく、他の変身タンパク質の動的な構造変換を解析する手法としても応用が期待されます。
今後の展開
本研究により、GFPとDHFRという二つのタンパク質を融合した変身タンパク質の設計に成功しましたが、より汎用的な設計原理の確立にはさらなる研究が必要です。特に、異なる機能を持つタンパク質をどのように融合させれば効率的かつ可逆的な構造変換を実現できるのか、その理論的な指針は未解明です。
これまでによく研究された変身タンパク質の中には、二つの立体構造の切り替えの欠陥とアルツハイマー病や自己免疫疾患との関連が示唆されているものもあります。変身タンパク質の普遍的な設計と制御方法の解明によって、疾患関連の変身タンパク質の構造変化を制御し、新しい治療戦略の開発に貢献できる可能性があります。
用語解説
掲載論文情報
- 論文タイトル
- Seesaw protein: Design of a protein that adopts interconvertible alternative functional conformations and its dynamics (シーソータンパク質: 相互変換可能な二つの機能性構造を持つタンパク質の設計)
- 著者
- Toma Ikeda, Tatsuya Nojima, Souma Yamamoto, Ryusei Yamada, Tatsuya Niwa, Hiroki Konno, and Hideki Taguchi
- 掲載誌
- Proceedings of National Academy of Sciences of United States of America (PNAS)
- 掲載日
- 2025.02.10
- DOI
- 10.1073/pnas.2412117122
- URL
- https://www.pnas.org/doi/10.1073/pnas.2412117122

