細胞が作り出す留め金の仕組みを解明
―器官の形が不可逆に作られる原理から組織工学・再生医療への貢献に期待―
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/医薬保健研究域附属サピエンス進化医学研究センターの奥田覚准教授と同大学院新学術創成研究科ナノ生命科学専攻博士前期課程2年/ナノ精密医学・理工学卓越大学院プログラム履修者の寺西亜生らの共同研究グループは、上皮シートの折り目がL字金具のようなアクチン分子(※1)の集積構造によって不可逆的に作られる仕組みを解明しました。
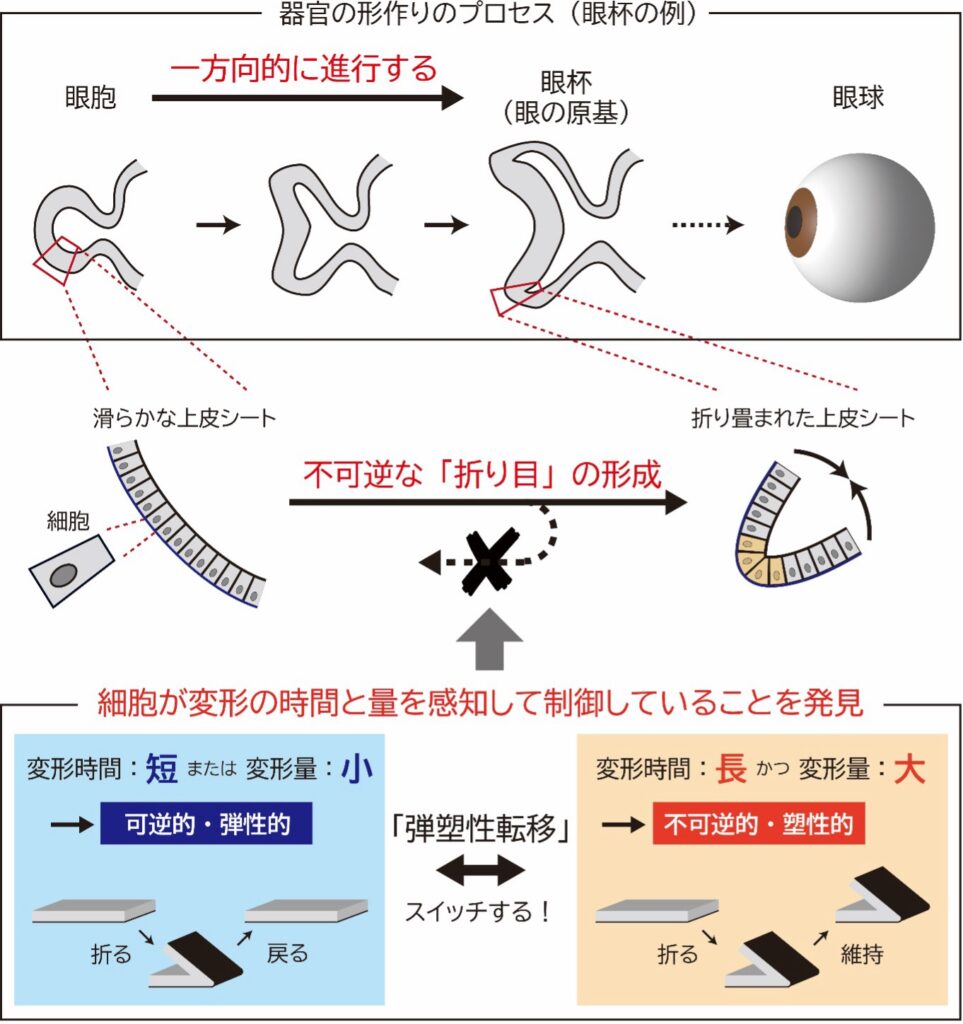
私たちの身体が作られる発生の過程において、シート状の上皮組織(※2)(以下、上皮シート)がまるで折り紙のように複雑に折り畳まれることで、各器官の「形」が作られます。この過程で重要なのは、上皮シートに「折り目」が一度形成されるとそれが元に戻らないという不可逆性を持つ点です。もし、この折り目が元に戻ると、複雑な形状が単純なシートに戻ってしまい、正常な器官の構造が形成できなくなってしまいます。そのため、この折り目の不可逆性は、身体や器官が正しく形作られるために不可欠な性質といえます。ところが、これまで生物学の歴史において、この「形が元に戻らない」という現象は当然の事実として捉えられ、その仕組みについては長い間不明のままでした。
本研究グループは、この折り目の不可逆性を計測するための新しい実験装置を開発し、培養した上皮シスト(※3)や脊椎動物の目の元となる眼杯のオルガノイド、マウス胚の眼組織に適用しました。その結果、上皮シートの折り目が不可逆となる過程は、加えられた変形の「時間」と「変形量」によって、スイッチのように変化することを、初めて明らかにしました。さらに、その仕組みは、加えられた変形の時間と変形量を細胞が感知して、L字金具のような「アクチンブラケット(※4)」構造を形成することで実現されることも発見しました。
これらの結果は、器官の形が不可逆に作られる根本的な仕組みを示しており、発生・再生現象の理解に加え、組織工学・再生医療分野において貢献が期待されます。
本研究成果は、2024年12月12日午前10時(英国時間)に英国科学誌『Nature Communications』に掲載される予定です。
研究の背景
近年、iPS細胞などの幹細胞を試験管の中で培養し、人工的に作製した組織を人体へ移植する「再生医療」の研究が盛んに行われています。しかし、試験管の中では、同じ培養条件であっても同じ形の組織が作られるわけではなく、作られる組織の形が大きくバラついてしまいます。そのため、現在のところ、網膜のような複雑な構造を持つ器官の立体形状を高精度に再現する技術は実現できていません。この問題を解決するためには、作製する器官の形作りの仕組みを理解し、その過程を試験管の中で正確に制御する必要があります。
器官が作られる発生の過程では、シート状の上皮組織(以下、上皮シート)がまるで折り紙のように複雑に折り畳まれることで、各器官の「形」が作られます。この過程で重要なのは、一度形成された上皮シートには「折り目」が元に戻らないという不可逆性がある点です。仮に折り目が元に戻ってしまう(可逆性がある)と、複雑な形状が単純なシートに戻ってしまい、正常な器官の構造を形成することができません。例えば、脳や眼、消化器など、多くの器官には数多くの折り目が存在し、それらのほとんどは発生の過程で形成され、生体が成長した後も維持されています。したがって、この折り目の不可逆性は、器官が正しく形成されるために不可欠な特性です。
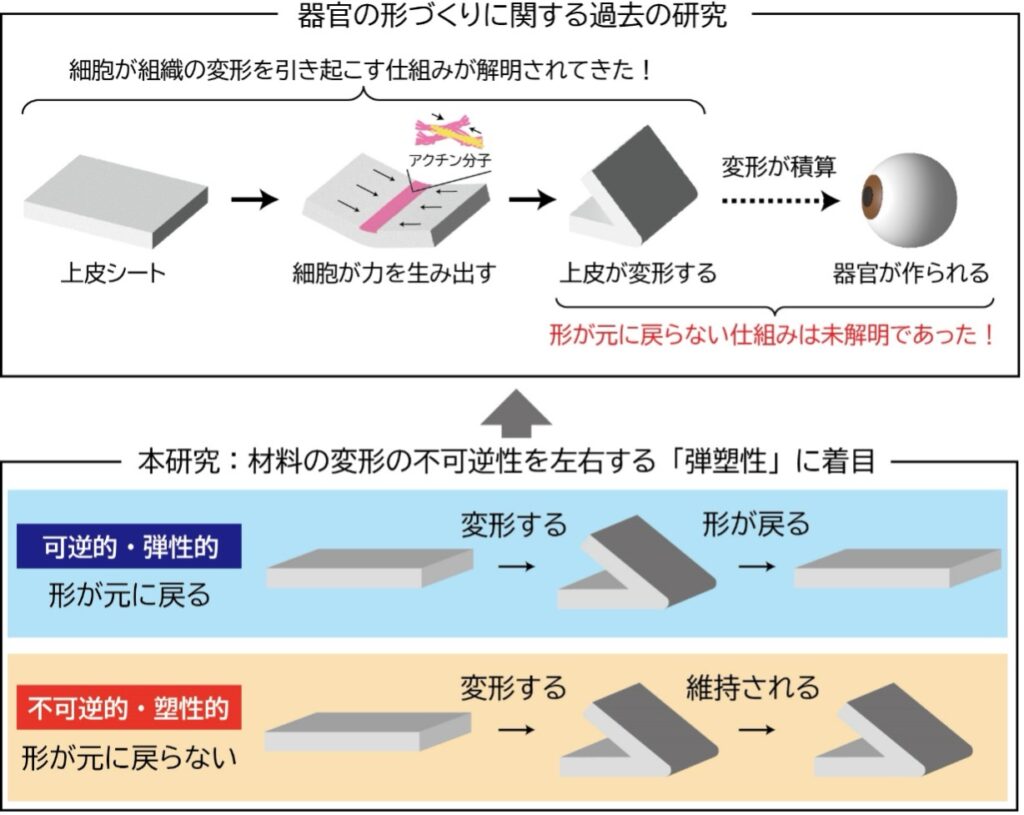
上皮シートの折り目の形成は、器官の形作りに深く関わっていることから、これまで多くの研究が行われてきました。特に、単純な上皮シートがどのようにして折り畳まれ、折り目が形成されるかという仕組みについては、さまざまな研究が進められてきました。例えば、これまでの研究により、上皮シートの折り目の内側(頂端面)において、細胞骨格を構成するアクチン分子やモータータンパク質(※5)であるミオシン分子が集まって収縮力を生み出すことで、上皮シートを一方向に曲げることが分かっています。ところが、こうして形成された折り目が「元に戻らない」という現象は、長い生物学の歴史において当然のこととされてきたため、その仕組みについては長らく未解明のままでした。では、この折り目の不可逆性はどのように生じるのでしょうか。
物質の変形に関する特性を扱う材料力学の学問分野では、「弾塑性(※6)」という特性が不可逆な変形を示す指標として知られています。弾塑性は、物体に変形が加えられた際に、変形が元に戻る「弾性」と、元に戻らず形が保持される「塑性」の両方を含む特性です。しかし、生きた細胞で構成される上皮シートに対して、折り目のような複雑な三次元変形を加える技術がこれまで存在しなかったため、この弾塑性の特性を調べることはできませんでした。
研究成果の概要
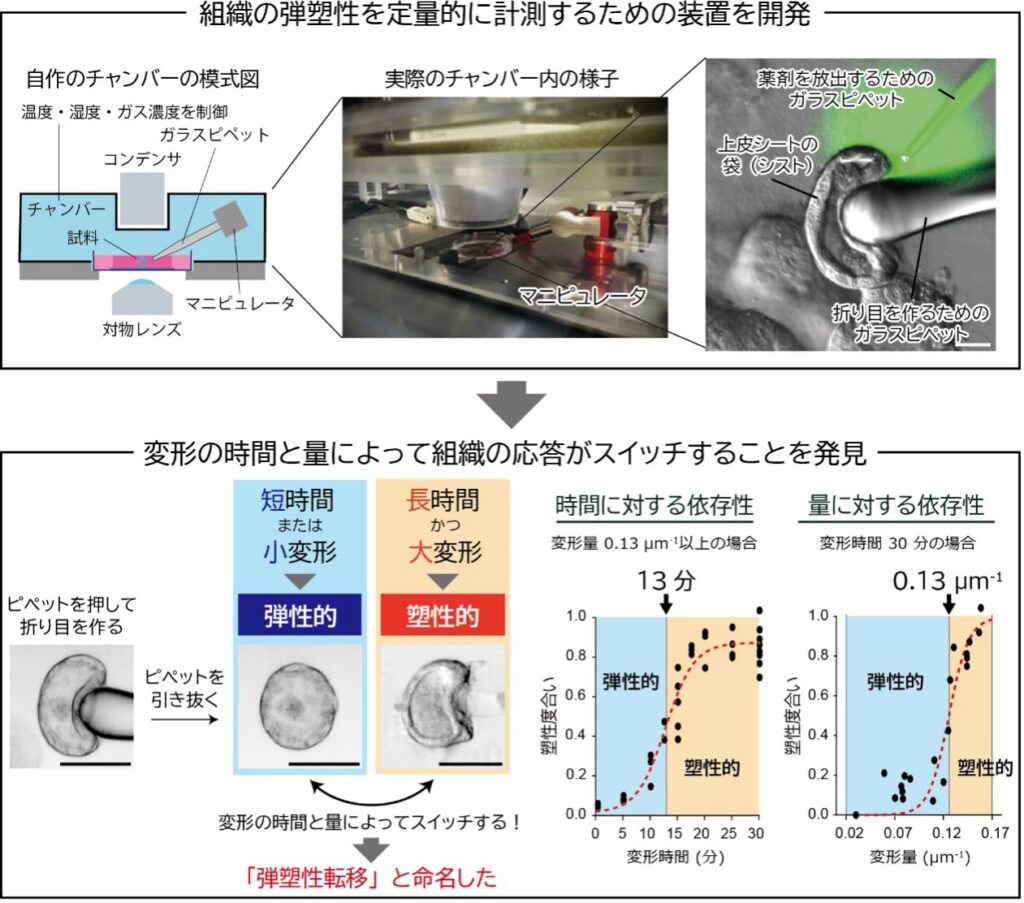
本研究では、細胞培養技術とマイクロ操作技術を組み合わせ、生きた上皮シートに対して複雑な三次元変形を加える新しい技術を開発しました。この技術により、上皮シートの折り目の弾塑性を計測することが可能になりました。具体的には、培養チャンバー内にピエゾマニピュレータ(※7)を設置してガラスピペットを操作し、立体的な上皮シートに折り目を作成しました。その後、ガラスピペットを一定時間保持し、ピペットを引き離した後に折り目が元に戻るかどうかを観察しました。
実験の結果、上皮シートの折り目が不可逆となる過程は、変形を加える「時間」と「変形量」によってスイッチのように変化することを初めて発見しました。特に、変形を加える時間が13分を超え、かつ、変形量(曲率)が0.13 μm-1を超えた場合、折り目は元に戻らず(不可逆/塑性的に)保持されることが分かりました。一方で、時間や変形量が閾値に満たない場合は、折り目が元に戻る(可逆/弾性的に)ことも明らかになりました。さらに、これらの弾性的・塑性的な応答は、閾値付近でスイッチのように急激に変化するため、この現象を「弾塑性転移」と名付けました。これらの結果から、上皮シートを構成する細胞は、加えられた変形の時間と量を感知し、弾性的または塑性的な応答を切り替えるメカニズムを持つと示唆されます。
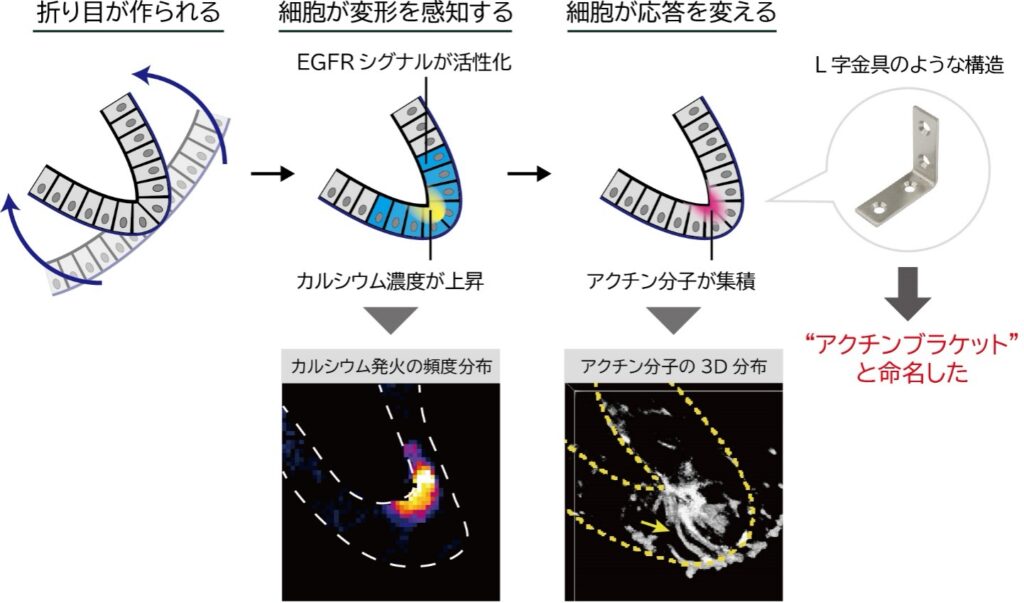
細胞が上皮シートに加えられた変形の「時間」と「量」をどのように感知するのかを解明するため、制御分子のライブイメージング観察(※8)と薬剤処理による分子機能阻害実験を行いました。その結果、上皮シートに与えられた変形量が閾値を超えると、二つの分子シグナルが活性化されることを発見しました。一つ目は、成長因子受容体であるEGFR(※9)とその下流のPI3kおよびAktです。二つ目は、機械刺激受容チャネル(※10)であるTRPC3/6と、その下流のカルシウム経路です。特に、このカルシウム経路は、カルシウム発火(細胞内のカルシウム濃度が一過的に上昇する現象)を伴い、上皮シートの折り目の頂端面で特異的に活性化されることが確認されました。これらの二つの分子シグナルは、弾塑性転移に必須であり、細胞がこれらのシグナルを通じて、上皮シートに加えられた変形を感知していることが解明されました。
最後に、細胞が弾性的または塑性的な応答を切り替えるメカニズムを探るため、細胞の形の維持や変形に重要なアクチン分子に着目しました。アクチン分子の蛍光ライブイメージング観察を行った結果、アクチン分子が折り目の頂端面に集まり、L字金具のような「アクチンブラケット」構造を形成する現象を発見しました。また、分子機能阻害実験によって、このアクチンブラケットが弾塑性転移を引き起こしていること、そしてその形成時間を操作することで、弾塑性転移の時間を制御できることを突き止めました。これらの結果から、細胞は分子シグナルを介して上皮シートに加えられた変形の時間と量を感知し、アクチンブラケットを形成することで、折り目の不可逆性を調整していることが明らかになりました。
今後の展開
本研究によって解明された「上皮シートの折り目の不可逆性を制御する仕組み」は、器官が一度形成されるとその形が元に戻らないという、発生生物学における根本的な疑問に答える画期的な発見です。上皮シートの折り目は、体内の多くの器官に存在するため、この発見により、各器官の発生や再生メカニズムに対する理解が一層深まることが期待されます。しかしながら、器官形成の過程でこの不可逆性がどのように制御されるかについては、依然として未解明な点が多く、今後さらなる研究が必要です。加えて、試験管内における器官形状の精密な制御は、再生医療における組織作製において今後の重要な課題となっています。本研究の知見は、こうした組織の形を精密に制御するための新たな指針を示しており、未来の組織工学や再生医療への貢献が期待されます。
用語解説
掲載論文情報
- 論文タイトル
- An actin bracket-induced elastoplastic transition determines epithelial folding irreversibility (上皮の折り目の不可逆性は力学感知によるアクチンブラケットの形成を介した弾塑性転移によって制御される)
- 著者
- Aki Teranishi, Misato Mori, Rihoko Ichiki, Satoshi Toda, Go Shioi, Satoru Okuda (寺西亜生、森美咲都、一木梨穂子、戸田聡、塩井剛、奥田覚)
- 掲載誌
- Nature Communications
- 掲載日
- 2024.12.12
- DOI
- 10.1038/s41467-024-54906-7
- URL
- https://www.nature.com/articles/s41467-024-54906-7