ゲノムDNAの機能を制御する遺伝子を発見 〜ゲノム編集やiPSリプログラミングに応用可能〜
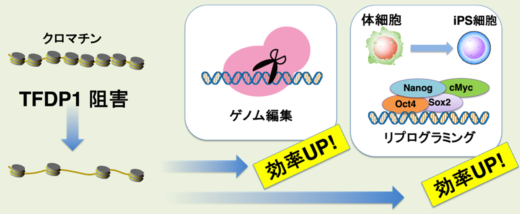
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/がん進展制御研究所の宮成悠介准教授,ナノ生命科学研究所(WPI-NanoLSI)の田川綾子研究員,基礎生物学研究所/総合研究大学院大学生命科学研究科の石井智子博士課程学生(研究当時)らの研究グループは,ゲノムDNAの機能制御に関与する遺伝子TFDP1を同定しました。さらに,TFDP1の機能を阻害することで,ゲノム編集(※1)やiPS細胞リプログラミング(※2)の効率を上げることに成功しました。
本研究では,転写因子TFDP1がクロマチン(※3)形成に必須なヒストンタンパク質の転写制御の中心的な役割を担っていることを見出しました。本研究成果は,遺伝子発現などのゲノム機能に関与するクロマチン構造がどのように制御されているのか,という生物学上の大きな謎の一つに答えるものです。また,TFDP1を阻害することで,細胞内のクロマチン構造を人為的に操作するユニークな方法を樹立しました。この技術は,ゲノム編集やiPS細胞リプログラミングだけでなく,ワクチン開発や再生医療分野など幅広い研究分野に活用されることが期待されます。
本研究成果は,2024年2月15日5時(米国東部時間)に国際学術誌『Nature Genetics』のオンライン版に掲載されました。
研究の背景
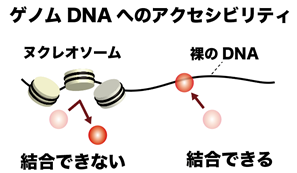 ヒトのゲノムDNAの大部分は,ヒストンタンパク質群に巻き付いたヌクレオソーム(※3)と呼ばれる構造をとります。一方で,一部のゲノム領域はヌクレオソーム構造をとらず,裸の状態で存在します。裸のDNA領域は,転写因子などのタンパク質がDNAに直接結合しやすい状態にあります。このような,タンパク質のゲノムDNAへの結合(アクセス)のしやすさの度合いを,アクセシビリティと呼びます。ゲノムDNAへのアクセシビリティは,遺伝子発現やDNA複製などのさまざまなゲノム機能を制御するための重要な働きをしています。そのため,アクセシビリティの異常は,がんを含める多様な疾患と結びついています。一方で,アクセシビリティを制御する分子メカニズムの全体像は未だに明らかになっておりません。そこで,本研究グループは,アクセシビリティの制御に関与する遺伝子群の探索を行いました。
ヒトのゲノムDNAの大部分は,ヒストンタンパク質群に巻き付いたヌクレオソーム(※3)と呼ばれる構造をとります。一方で,一部のゲノム領域はヌクレオソーム構造をとらず,裸の状態で存在します。裸のDNA領域は,転写因子などのタンパク質がDNAに直接結合しやすい状態にあります。このような,タンパク質のゲノムDNAへの結合(アクセス)のしやすさの度合いを,アクセシビリティと呼びます。ゲノムDNAへのアクセシビリティは,遺伝子発現やDNA複製などのさまざまなゲノム機能を制御するための重要な働きをしています。そのため,アクセシビリティの異常は,がんを含める多様な疾患と結びついています。一方で,アクセシビリティを制御する分子メカニズムの全体像は未だに明らかになっておりません。そこで,本研究グループは,アクセシビリティの制御に関与する遺伝子群の探索を行いました。
研究成果の概要
本研究では,CRISPRスクリーニングという手法を用いて,ヒトの全ての遺伝子を一個ずつ破壊し,アクセシビリティの制御に関与する遺伝子をスクリーニングしました。スクリーニングによって同定された遺伝子群の中でも,転写因子であるTFDP1を破壊すると,ゲノム全体のアクセシビリティが顕著に上昇することを見出しました。TFDP1は古くから研究が進められていた転写因子ですが,アクセシビリティに関与することを発見したことは本研究が初めてであり,非常に驚きでした。TFDP1によるアクセシビリティ制御の分子メカニズムを研究する過程で,TFDP1がヌクレオソームの構成因子であるヒストンタンパク質群の転写調節に深く関与していることを見出しました。TFDP1の機能を阻害すると,ヒストンタンパク質の発現量が低下し,ヌクレオソームの量も低下します。それに伴い,裸のゲノムDNA領域の割合が増えるため,ゲノム全体のアクセシビリティが上昇します。
さらに本研究グループは,TFDP1阻害によるアクセシビリティ上昇というユニークな現象を技術展開できないかと考えました。CRISPR/Cas9を用いたゲノム編集および山中因子を用いたiPS細胞リプログラミングには, Cas9や山中因子などのDNA結合タンパク質が,細胞内のゲノムDNAにアクセスする必要があります。しかしながら,ほとんどのゲノム領域はヌクレオソームで覆われているためアクセシビリティが低く,そのことがゲノム編集やリプログラミングを妨げる原因の一つでした。本研究グループは,TFDP1を阻害した細胞では,ゲノムDNAへのアクセシビリティが上昇しているため,Cas9やOct4などのタンパク質が効率よくゲノムDNAにアクセスできることを発見しました。その結果,ゲノム編集およびiPS細胞の作成効率を上げることに成功しました。
今後の展開
本研究では,ゲノムDNAのアクセシビリティが細胞内でどのように制御されているのか,という大きな謎の一端を明らかにすることができました。今後研究を発展させることで,ゲノムDNAの制御機構の分子メカニズムだけでなく,アクセシビリティの異常によって引き起こされるさまざまな疾患の原因究明につながると予想されます。さらに,TFDP1阻害のように,アクセシビリティを人為的に操作する技術は,ゲノム編集やiPSリプログラミングだけでなく,ワクチン開発や再生医療分野をはじめ幅広い研究分野への応用展開にもつながることが期待されます。
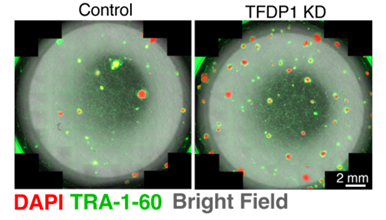
体細胞リプログラミングによって作製されたiPS細胞コロニーの光学顕微鏡写真
TFDP1を阻害(右)することにより,リプログラミング効率が上昇するためiPS細胞のコロニー数が比較対象(左)と比べて増える。
© 2024 Ishii, et al., under exclusive license to Springer Nature America, Inc.
研究室ウェブサイト
https://sites.google.com/view/miyanarilab/home
用語解説
掲載論文情報
- 論文タイトル
- Genome-wide ATAC-see screening identifies TFDP1 as a modulator of global chromatin accessibility (網羅的なATAC-seeスクリーニングによるクロマチンアクセシビリティ調節因子TFDP1の同定)
- 著者
- Satoko Ishii, Taishi Kakizuka, Sung-Joon Park, Ayako Tagawa, Chiaki Sanbo, Hideyuki Tanabe, Yasuyuki Ohkawa, Mahito Nakanishi, Kenta Nakai, Yusuke Miyanari (石井智子,垣塚太志,朴 聖俊,田川綾子,三宝千秋,田辺 秀之,大川 恭行,中西 真人,中井 謙太,宮成悠介)
- 掲載誌
- Nature Genetics
- 掲載日
- 2024.02.15
- DOI
- 10.1038/s41588-024-01658-1
- URL
- https://www.nature.com/articles/s41588-024-01658-1