抗酸菌における決定的な休眠誘導機構を発見
-天然変性タンパク質による新規のDNA凝集メカニズム-
金沢大学ナノ生命科学研究所の古寺哲幸教授は、新潟大学大学院医歯学総合研究科細菌学分野の西山晃史講師、松本壮吉教授、京都大学複合原子力科学研究所(清水将裕助教)、九州大学生体防御医学研究所(眞栁浩太講師[現・同大学大学院薬学研究院])、大阪公立大学(山口雄大助教[現・国立感染症研究所])、新潟大学大学院自然科学研究科(伊東孝祐准教授)らとの共同研究で、抗酸菌の天然変性ヒストン様タンパク質mycobacterial DNA-binding protein 1(MDP1)が、他の核酸結合タンパク質では報告のない、天然変性領域(※1)を介した新規のDNA凝集メカニズムを介して抗酸菌の休眠を誘導することを明らかにしました。
本研究成果は、2024年1月25日発刊のオックスフォード大学出版の科学誌「Nucleic Acids Research」に掲載されました。
本研究成果のポイント
- 結核や非結核性抗酸菌(NTM)症などの抗酸菌症は、難治性であり、投薬期間は半年から年単位に及ぶ。この根底に、休眠して薬剤パーシスター(※2)化する抗酸菌の性質があるが、休眠期に誘導される分子の解析が盛んに行われてきた中で、実際に休眠を誘導する分子は報告されていなかった。
- 結核は人類史上最も多くの人命を奪ってきた。2022年の死亡者数は157万人に上った。休眠結核菌による潜伏感染(潜在性結核(※3))は世界人口の1/4に及ぶとされ、活動性結核の主要な発生源である。休眠菌は多くの薬剤にも抵抗性で、長期投薬を要する元凶である。
- 抗酸菌のヒストン様タンパク質は、細菌では希なヒストンに似た天然変性領域を持ち、その作用で休眠を誘導する。
- 本研究グループでは、高速原子間力顕微鏡(高速AFM)(※4)によるタイムラプス撮影と、分子動力学計算を組み合わせることによって、MDP1の天然変性領域が両面テープのように2本のDNA二重らせんを貼り合わせていくという、他の核酸結合タンパク質では報告されていない、新規のDNA凝集メカニズムを解明した。
- MDP1の天然変性領域は、抗酸菌と一部のストレス耐性菌に特徴的で、強力な休眠誘導活性を持っていた。本研究成果は、未知であった抗酸菌の休眠誘導の決定的なメカニズムを明らかにした。また本成果は、休眠菌にも有効で、既存薬との交差耐性が無い薬剤の開発にも繋がることが期待される。
研究の背景
細胞は増殖を停止すると老化し、次第に死に近づきますが、一部の細菌は、増殖を停止した後も長期間、生き続けることが知られています。これを休眠「dormancy」と呼びます。休眠すると薬剤にも擬似的に耐性(Tolerance)となることから、病原性細菌が休眠すると、難治性となるケースが多いです。その好例が、結核や非結核性抗酸菌(NTM)症などの抗酸菌による感染症です。
結核は人類史上最も多くの人命を奪ってきた感染症であり(Paulson, Nature 2013)、2022年の死亡者数は157万人に上りました(HIV陽性患者を含む, WHO, World Tuberculosis Report 2023)。結核では、休眠結核菌による潜伏感染(潜在性結核)が世界人口の1/4に及ぶと推計され、活動性結核の主要な発生源となっています。また、休眠菌は多くの薬剤に抵抗性であり、結核の治療に長期投薬を要する元凶となっています。
結核菌を含めた全ての抗酸菌が発現するMDP1は、全ての細菌が発現するヒストン様タンパク質HUの仲間です。興味深いことに、MDP1のHU構造には、細菌では非常に希なヒストンに似た天然変性領域が付加されています(図1A)。MDP1は低酸素休眠菌で高発現します。天然変性領域の作用で休眠(染色体凝集、増殖抑制等)を誘導します。
研究の概要
本研究では、MDP1の休眠誘導作用に関わる、天然変性領域を介したDNA凝集メカニズムの解明を目指しました。一定の構造を取らない天然変性領域は通常の構造解析が困難なため、分子の動きをナノメータースケールでタイムラプス撮影可能な高速AFMを用いて、MDP1によるin vitroでのDNA凝集過程を撮影しました。また、粗子化分子動力学計算(※5)による本DNA凝集過程の再現を組み合わせることによって、MDP1天然変性領域によるDNA架橋メカニズムを解明しました。
研究の成果
MDP1が隣接する2本のDNA二重らせんを、ジッパーを閉じるように貼り合わせて束ねていく凝集過程を高速AFMによるタイムラプス撮影で捉え(図1B)、天然変性領域がこの活性を担っていることを明らかにしました。また、高速AFM解析で、天然変性領域の先端にtagを付加した融合タンパク質を用いることによって、DNA凝集過程の天然変性領域の動きを追跡することに成功しました(図1C)。さらに、粗子化分子動力学計算によって、MDP1のDNA凝集過程の計算モデルを構築しました(図1D)。これらの結果を組み合わせることによって、他の核酸結合タンパク質では報告がない、天然変性領域が2本のDNA二重らせんの間に伸長して静電引力で両面テープのように貼り合わせる新規のDNA架橋メカニズムを解明しました。このDNA架橋が連続的に形成されることにより、広範囲のDNA凝集を誘導すると考えられます。また、天然変性領域によるDNA架橋は可逆的な構造でした。
MDP1を抗酸菌で過剰発現させると、天然変性領域の作用で染色体凝集を誘導します。また、生存率を大きく低下させることなく増殖を抑制し、菌を休眠させます(図1E)。この天然変性領域を大腸菌HUに融合させると、大腸菌HUの活性を支配し、MDP1様のDNA凝集活性、強力な菌の休眠誘導活性を示しました(図1E)。
MDP1の天然変性領域は、抗酸菌と一部のストレス耐性菌に特徴的で、強力な休眠誘導活性を持っていました。本研究で解明したMDP1天然変性領域による可逆的なDNA架橋・凝集の構造モデルは、抗酸菌の休眠と覚醒の制御に適したメカニズムであることが示唆されました。
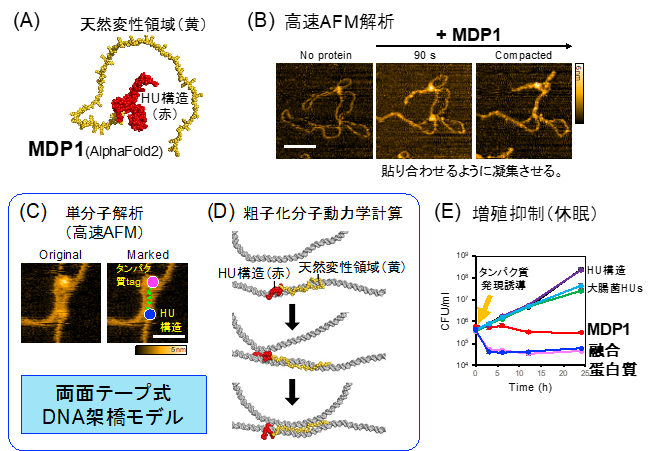
図1. MDP1 による天然変性領域依存的なDNA 架橋・凝集作⽤
A. MDP1 の構造。AlphaFold2 で予測。⾚⾊はHU 構造(単量体)。⻩⾊は天然変性領域。
B. ⾼速AFM でタイムラプス撮影したMDP1 のDNA 凝集過程。
C, D. 天然変性領域による両⾯テープ式DNA 架橋モデル。Tag 融合タンパク質を⽤いた観察(C)と粗⼦化分⼦動⼒学計算による再現(D)。
E. MDP1 天然変性領域を介した抗酸菌の増殖抑制作⽤。
今後の展開
休眠して、薬剤パーシスター化する抗酸菌の感染症は、治療期間が長く、難治性であることが特徴で、社会問題となっています。抗酸菌の休眠における重要なメカニズムが分かったことで、結核や非結核性抗酸菌(NTM)症などの抗酸菌症の創薬が大きく前進することが期待されます。
また、増殖を停止した後にも生き続ける「休眠」のメカニズムを解明していくことで、生物共通の長寿のメカニズムにも迫る可能性があります。
© Akihito Nishiyama, et al. 2023. Published by Oxford University Press on behalf of Nucleic Acids Research.
用語解説
掲載論文情報
- 論文タイトル
- Dynamic action of an intrinsically disordered protein in DNA compaction that induces mycobacterial dormancy
- 著者
- Akihito Nishiyama, Masahiro Shimizu, Tomoyuki Narita, Noriyuki Kodera, Yuriko Ozeki, Akira Yokoyama, Kouta Mayanagi, Takehiro Yamaguchi, Mariko Hakamata, Amina Kaboso Shaban, Yoshitaka Tateishi, Kosuke Ito, Sohkichi Matsumoto
- 掲載誌
- Nucleic Acids Research
- 掲載日
- 2024.01.25
- DOI
- 10.1093/nar/gkad1149
- URL
- https://doi.org/10.1093/nar/gkad1149

