電位依存性Na⁺チャネルの意外な構造と 分子間相互作用の発見!
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の角野 歩助教,WPI-NanoLSI/JSTさきがけ研究者の炭竈享司特任助教,和歌山県立医科大学の入江克雅准教授の共同研究グループは,電位依存性Na+チャネル(Nav)(※1)のこれまで不明だった室温で動いている構造を高速原子間力顕微鏡(高速AFM)(※2)によって解明し,さらに予期せぬチャネル分子間の相互作用の存在を発見しました。
電位依存性Na+チャネル(Nav)は生体の活動に必要な電位(活動電位)を発生するため,生体にとって不可欠な膜タンパク質です。そのため,Navの構造と機能の関係を明らかにする研究が広く行われてきましたが,細胞膜内で機能している際のNavの構造や,Nav同士の相互作用には不明点が多く残されていました。
このたび本研究グループは,室温でのタンパク質の動態観察が可能な高速AFMを用いることで,Navが閉じるとNavの電位センサーはNavから離れて二量体を形成することを解明しました。さらに,理論計算により,この二量体化は現実の神経においても起きうることを明らかにし,二量体化がこれまで不明であったNavの急峻な活動電位発生の分子実態である可能性を示しました。
これらの知見は将来,活動電位の波形の異常を修正する薬剤の一つの開発指針となることが期待されます。 本研究成果は,2023年12月19日午前10時(英国時間)に国際科学雑誌『Nature Communications』に掲載されました。
研究の背景
私たちの体の中では,常に活動電位という電気信号が駆け巡っており,そのおかげで私たちは考えたり,身体を動かしたりしています。例えば,心電図は心臓での活動電位,脳波は脳での活動電位を計測したものです。活動電位を形作るためには,細胞膜を横切るイオンの透過性(イオン種ごとの透過しやすさ)が時々刻々と精密に変化する必要があります。細胞膜に存在する電位依存性Na+チャネル(Nav)という膜タンパク質は,細胞膜内外の電位の変化に応じてNa+の通路を開閉し,細胞膜のNa+透過性を制御します。Navの開口によって活動電位の形成が開始されるため,Navが働く仕組みを解明することは生命科学分野の最重要課題の1つと言えます。
Navが働く分子メカニズムを理解するため,これまでに,X線結晶構造解析や低温電子顕微鏡の単粒子解析などといった構造解析が盛んに行われてきました。そしてそれらの先行研究の結果から,Navは四量体を形成して中心にイオンの透過路を形作り(ポア領域),その周囲には電位センサーと呼ばれる膜電位を感知する領域が,常にぴったりと結合していると考えられてきました(図1a)。しかし,さまざまな技術的制約により,Na+の通路が閉じた状態(閉状態。電気刺激のない通常の状態では閉じている)の分子構造は,不明点が多く残されており,特に室温で動いて機能しているNavの構造は観察されていませんでした。また,Navが協同的に開くことで活動電位が急峻に発生するという説がありますが,どのようなNav間の相互作用が協同性を生むのかは,ほとんど分かっていませんでした。今回我々は,これまでと違った新しい手法でのNavの構造観察が,これらの問題の解決につながると考えました。そこで,室温での膜タンパク質の表面構造とその動態をナノスケールで観察することができる高速原子間力顕微鏡(高速AFM)を用いて,閉状態およびNa+の通路が開いた開状態でのNavの構造を可視化しました(図1b)。

図1. (a)Navの構造(PDB:4ekw),(b)高速AFM観察の模式図,(c)実験に用いたNavの電位依存性
研究成果の概要
閉状態および開状態でのNavの構造を観察するために,遺伝子操作によって電位依存性を変化させた変異体のNavを作りました(図1c)。0 mVにおいて野生型では開状態になり,E32Q/N49Kという変異体では閉状態になります。これらのNavを単離精製し,細胞膜を模倣した脂質二分子膜に再構成して高速AFM観察を行いました。まず,どちらの変異体においても4つの粒子が四角に並んだポアドメインに相当する構造が観察されました。ここまでは想定内でしたが,興味深いことに,開状態のNavでは電位センサーに相当する粒子がポアドメインにぴったりと結合していたのに対し(図2a-d),閉状態のNavでは,電位センサーがポアドメインから大きく離れていることが分かったのです(図2e-h)。
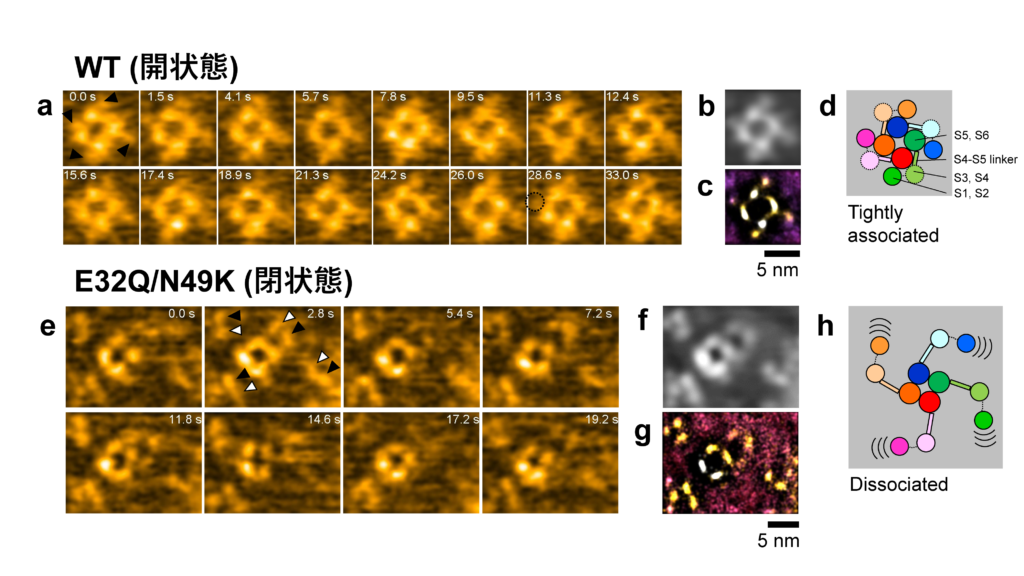
図2.Navの高速AFM観察結果 (a, e)開状態および閉状態のNavの高速AFM観察結果,(b, f)a, eの時間平均画像, (c, g)a, eの局在AFM画像,(d, h)観察結果の模式図
さらに,もう1つ予期せぬ発見がありました。閉状態のNavを観察していると,まるで電位センサーが2つくっついたような構造が多数観察されたのです(図3a)。生体内には電位センサーのみで機能するH+チャネル(Hv)が存在しますが,Hvは生体内で二量体を形成することが分かっています。我々は,既に報告されていたHvの二量体の構造と,Navの電位センサードメインの構造を組み合わせて電位センサーの二量体のモデルを作成し(図3b),高速AFMで観察された構造と比較しました(図3c, d)。すると両者は非常によく似ていて,高速AFMで発見した構造は,電位センサーの二量体と考えられると結論付けました。これらの情報をまとめると,電位センサードメインは,閉状態でポアドメインから解離するだけでなく,チャネル間を架橋するように二量体を形成するということです。有髄神経におけるNavは高密度(1500分子/μm2)に集積することが分かっており,仮に今回発見した静止状態のNavの分子サイズ(直径約20 nm)がランダムに分布すると考えても,8割以上のNavがほかのNavと相互作用すると予測されました(図3e, f)。つまり,今回発見したNavの電位センサーの二量体化は,生理的条件でも十分起こりえるものであり,Navの協同的な開口機構と急峻な活動電位発生の分子実態である可能性があります(図4)。
今後の展開
活動電位の波形は,わずかに変形するだけでさまざまな疾患につながることが分かっています。本研究により,Navの協同的活性化の分子機構が提案できたことで,活動電位の波形を修正する薬剤開発などへの新たな開発指針を提供できることが期待されます。
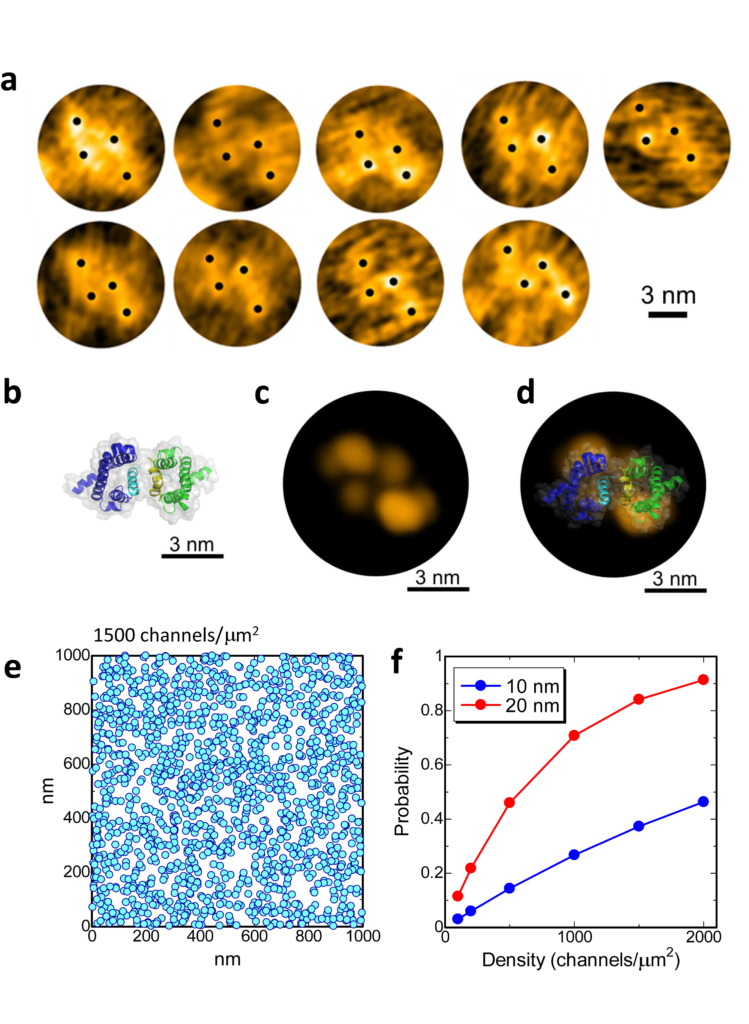
図3. 閉状態の電位センサーの二量体化
(a)高速AFMで捉えた構造,(b)電位センサーの二量体の構造モデル,(c)bの構造のAFMシミュレーション像,(d)bとcの重ね合わせ,(e)直径約20 nmの粒子を1500個/μm2の密度でランダムに配置した図,(f)直径10もしくは20 nmのランダムに配置したチャネルが他のチャネルと相互作用する確率の理論計算結果
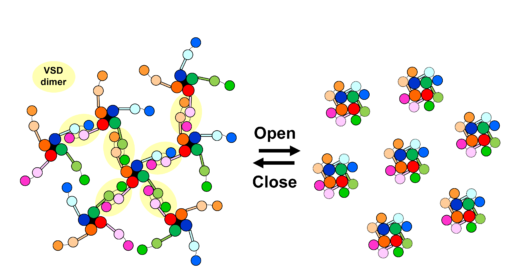
図4. 電位センサーの二量体を介したNavのネットワーク形成・解離と協同的活性化の模式図
用語解説
掲載論文情報
- 論文タイトル
- Voltage sensors of a Na+ channel dissociate from the pore domain and form inter-channel dimers in the resting state (静止状態の電位依存性Na+チャネルの電位センサーはポアから解離し,チャネル間で二量体化する)
- 著者
- Ayumi Sumino, Takashi Sumikama, Mikihiro Shibata, Katsumasa Irie (角野 歩,炭竈 享司,柴田 幹大,入江 克雅)
- 掲載誌
- Nature Communications
- 掲載日
- 2023.12.19
- DOI
- 10.1038/s41467-023-43347-3
- URL
- https://www.nature.com/articles/s41467-023-43347-3

