細胞外小胞によるトランスサイレチンアミロイドの沈着機構を解明
金沢大学ナノ生命科学研究所の華山力成教授,医薬保健研究域医学系の河原裕憲助教,医薬保健研究域医学系脳老化・神経病態学(脳神経内科学)の山田正仁名誉教授(現・九段坂病院副院長),大学院医薬保健学総合研究科博士課程学生の山口浩輝さんらの研究グループは,ATTRアミロイドーシスにおける細胞外小胞(※1)によるタンパク質凝集体(アミロイド)の沈着機構の解明に成功しました。
ATTRアミロイドーシスはトランスサイレチン(TTR)(※2)が凝集し形成されたTTRアミロイドが全身の諸臓器に沈着し,進行性の臓器障害を呈する予後不良の疾患の総称で,TTR遺伝子変異に起因するATTRv アミロイドーシスと遺伝子変異を伴わない野生型 ATTR(ATTRwt)アミロイドーシスに大別されます。最近ではアントニオ猪木さんもATTR アミロイドーシス(心アミロイドーシス)で闘病していることを公表されています。しかし,体内におけるTTRの凝集・沈着機構はこれまでよく分かっていませんでした。
今回,本研究グループは,血液中に存在する細胞外小胞がTTRの凝集化や細胞への沈着を促進することを見出し,TTRアミロイドの沈着機構の新たなモデルを提唱しました(図1)。まず,健康なヒト血液中に存在する細胞外小胞にTTRが存在するかを解析したところ,細胞外小胞の膜表面に存在することが明らかとなりました。また精製したTTRをヒト血液由来の細胞外小胞と反応させ,高速原子力間顕微鏡(※3)で観察すると,粒子のサイズ増加がリアルタイムに観察され, TTRの凝集化促進直接観て確認することができました。。特に遺伝子変異型TTR(V30M-TTR)が顕著に凝集することが確認されました。次に,ヒト血液由来の細胞外小胞がTTRアミロイドの細胞沈着に関与するかを解析したところ,変異型TTRだけでは細胞への沈着はほとんど観察されませんでしたが,ヒト血液由来の細胞外小胞と一緒に添加することで,細胞へのTTRアミロイドの沈着が顕著に増加しました(図2)。さらに,ATTRvアミロイドーシス患者と健常者の血液検体を用いて解析したところ,血液由来の細胞外小胞の量が健常者と比べて増加傾向にあり,細胞外小胞に含まれるTTRアミロイドの量が健常者と比べて低下していることも分かりました(図3)。
本研究により,ATTRvアミロイドーシスにおいて細胞外小胞がTTRの凝集促進・アミロイド沈着に深く関与していることが明らかとなり,細胞外小胞の産生を抑えることで,組織へのアミロイド沈着を阻止できる可能性が示唆されました。今後はATTRアミロイドーシスの早期発見や治療法の開発へと研究が発展することが期待されます。
本研究成果は,2022年3月23日にスイス国際科学誌『Frontiers in Molecular Biosciences』のオンライン版に掲載されました。
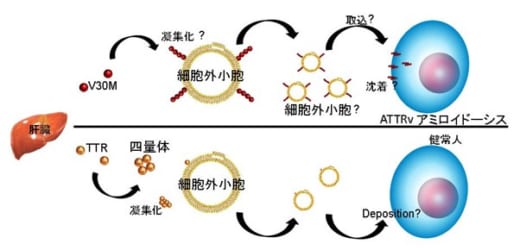
図1.細胞外小胞によるATTRvアミロイドーシスの沈着モデル
肝臓で産生されたトランスサイレチンは四量体として安定化している。変異型TTR(V30M-TTR)は野生型 TTRよりも凝集化を起こしやすいが,細胞外小胞の存在下では更に凝集化が促進される。細胞外小胞に付随したTTRアミロイドは細胞に沈着しやすくなる為,諸臓器にTTRアミロイドが溜まりやすくなり,疾患の発症につながると考えられる。
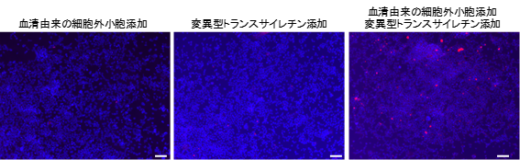
図2.細胞外小胞によるTTRアミロイド形成の促進
ヒト血清由来の細胞外小胞や変異型TTR(V30M-TTR)をそれぞれ単独に添加した細胞では,TTRアミロイドはほぼ観察されない。一方,細胞外小胞と変異型TTRを同時に細胞へと添加すると,TTRアミロイドの形成が観察され,細胞外小胞の存在下でTTRの凝集が促進されることが明らかとなった。
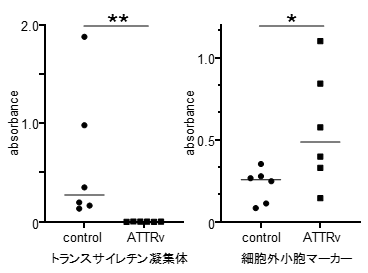
図3.患者における細胞外小胞上TTRアミロイドと細胞外小胞の量の変化
健常人(control)およびATTR アミロイドーシス患者(ATTRv)の血液から細胞外小胞を回収し,細胞外小胞上TTRアミロイドと細胞外小胞の量をELISA法にて測定した。健常人に比べて,患者では TTRアミロイド量の低下と細胞外小胞量の増加が観察された。これは,患者の体内では細胞外小胞がより積極的にTTRアミロイドを組織に沈着させる為と考えられる。
掲載論文情報
- 論文タイトル
- Extracellular Vesicles Contribute to the Metabolism of Transthyretin Amyloid in Hereditary Transthyretin Amyloidosis(細胞外小胞がATTRvアミロイドーシスのトランスサイレチン代謝を制御する)
- 著者
- 河原 裕憲、華山 力成
- 掲載誌
- Frontiers in Molecular Biosciences
- 掲載日
- 2022.03.23
- DOI
- 10.3389/fmolb.2022.839917