がん組織で起こる高頻度な悪性化消失と ネガティブ選択による排除機構を発見
金沢大学ナノ生命科学研究所/がん進展制御研究所の中山瑞穂准教授,大島正伸教授の研究グループは,腸がん由来オルガノイド(※1)のモデル研究により,悪性化に逆行する細胞集団が,予想以上の頻度で出現していることを発見しました。
がんの悪性化は,遺伝子変異により生存に有利な形質を獲得した腫瘍細胞が,選択的に増殖することで進行すると考えられています。このようながんの悪性化機構は,ダーウィン進化論(※2)に共通する機構として考えられています。しかし,遺伝子変異により悪性化形質を獲得したがん細胞が,その形質を維持し続けるのかについて,いまだ十分な解析が行われていませんでした。
がん研究に広く使われる株化がん細胞は,均一な悪性化細胞が選択されているため,何度継代しても悪性化形質が維持されています。一方で,オルガノイド培養したがん細胞集団では悪性度に関する多様性が維持されており,個々の細胞の悪性化形質を追跡することが可能と考えました。研究グループは,4種類の大腸がんのドライバー遺伝子(※3)変異導入により発生したマウス腸管がんからオルガノイドを樹立して,サブクローニング(※4)および移植実験を行い,遺伝子変異により転移性を獲得したがん細胞集団の約30%の細胞で転移性を失っていることを発見しました。また,転移能を失ったがん細胞は,生体内に近い培養条件での増殖率が顕著に低下しており,次第にがん細胞集団からネガティブな選択により排除される可能性を示しました。
これらの知見は,従来考えられたダーウィン進化に基づくがん悪性化モデルに加えて,ネガティブ選択による新たな悪性化の維持機構の存在を示し,将来的には大腸がん治療薬の開発に活用されることが期待されます。
本研究成果は2022年12月28日(日本時間)に『Cancer Science』誌のオンライン版に掲載されました。
研究の背景
ドライバー遺伝子変異により,生存や増殖に有利な形質を獲得した腫瘍細胞が,がん組織内で選択的に増殖することで,がんは段階的に悪性化すると考えられています。この概念はダーウィンの進化論と共通する機構として説明されます。しかし,複数の遺伝子変異を蓄積して悪性化形質を獲得したがん細胞は,永続的に悪性化形質を維持しているのかなど,その運命については十分に解析されていませんでした。
研究成果の概要
研究グループでは,大腸がん発生と悪性化に重要な4種類のドライバー遺伝子(Apc,Kras,Tgfbr2,Trp53)に変異を導入したマウスモデルの腸管腫瘍からオルガノイドを樹立しました(Sakai et al, Cancer Res, 2018)。樹立したオルガノイドのAKTP細胞をマウス脾臓に移植すると高頻度に肝転移巣を形成することが,以前の研究で明らかにされています(Kok et al, Nat Commun, 2021)。そこで,AKTP細胞を酵素処理により単一細胞とし,それぞれの細胞を増殖させてサブクローン細胞株を樹立し,脾臓移植実験を実施した結果,約30%のサブクローンで転移能が失われていることが明らかになりました(図1)。転移能を消失したがん細胞では,4種類のドライバー遺伝子変異が確認されたため,遺伝子変異により獲得した悪性化形質には,それを維持するために他のメカニズムが存在することが考えられました。
通常の細胞培養ディッシュ上では,転移能を失ったがん細胞も,転移性を維持したがん細胞と同様に増殖しましたが,より生体内に近いコラーゲンゲル上の培養では,転移能を失った細胞の顕著な増殖抑制が認められ,継代培養の過程で細胞集団から排除されました(図2)。この結果は,体内のがん組織でも,悪性化形質を失った細胞が出現しては,ネガティブ選択機構により排除されている可能性を示しています。
さらに,転移能を失ったサブクローンは継代培養を続けても,転移性を再度獲得することはありませんが,転移性を維持したサブクローンでは,継代培養により転移性を消失する現象が認められ,転移性消失が一方向性に起こる現象と考えられました。
さらに,転移性を消失したサブクローンでは,幹細胞性を示すLgr5などの遺伝子発現が顕著に低下しており,がん細胞の未分化性が維持されないため,生体内の増殖や転移巣形成能力が低下したと考えられました。この知見は,ダーウィン進化で説明されるがんの悪性化モデルに,ネガティブ選択の概念を導入し,がん進化の概念に重要な貢献が期待されます。
今後の展開
本研究成果から,転移性などの悪性化形質は,原因となる遺伝子変異以外に,それを維持する重要なメカニズムが存在することが考えられ,さらに,その分子機構を解明することにより,がん転移に対する新規予防・治療薬の開発戦略に大きな貢献が期待されます。
研究資金
研究は,日本医療研究開発機構(AMED)(22ck0106541h0003; 22gm4010012h0002),日本学術振興会科学研究費助成事業(基盤研究(A)/基盤研究(C)),および文部科学省世界トップレベル研究拠点プログラム(WPI)の支援を受けて実施されました。
参考図
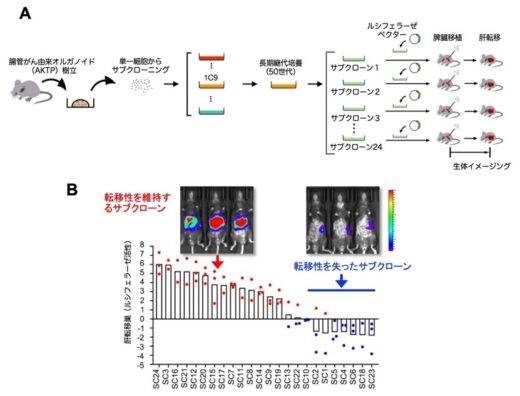
図1. 転移性腸がん由来AKTPオルガノイドにおける転移能消失。(A)サブクローニング方法。転移能を獲得した腸管腫瘍からAKTPオルガノイド(1C9)を樹立し,約50世代の長期継代培養の後,単一細胞から24個のサブクローンを作成。(B)各サブクローンを脾臓移植し,ルシフェラーゼによる生体イメージングで肝転移巣を観察すると,約30%で転移性の消失が見られた。
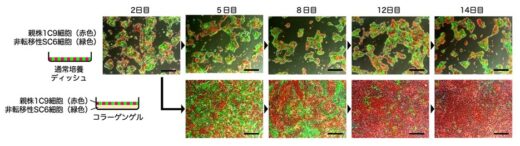
図2.転移性を消失したがん細胞のネガティブ選択による排除。転移性を維持する親株細胞(1C9)を赤色,転移能を失ったサブクローン細胞(SC6)を緑色の蛍光タンパクでそれぞれ標識し,通常培養ディッシュ上で共培養すると双方の細胞集団が均等に増殖を継続するが(上段),コラーゲンゲル上で培養すると,転移能消失細胞は次第に集団から排除される(下段)。
用語解説
掲載論文情報
- 論文タイトル
- Frequent loss of metastatic ability in subclones of Apc, Kras, Tgfbr2 and Trp53 mutant intestinal tumor organoids
(Apc,Kras,Tgfbr2,trp53に変異を導入した腸管腫瘍オルガノイドで見られる高頻度な転移能の消失) - 著者
- Atsuya Morita, Mizuho Nakayama, Dong Wang, Kazuhiro Murakami, Masanobu Oshima
(森田敦也,中山瑞穂,ドン・ワン,村上和弘,大島正伸) - 掲載誌
- Cancer Science
- 掲載日
- 2022.12.28
- DOI
- 10.1111/cas.15709
- URL
- https://doi.org/10.1111/cas.15709

