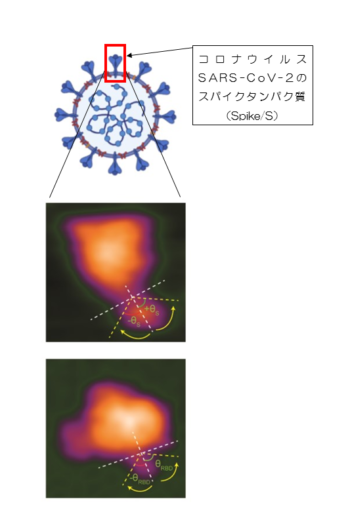
世界初!高速AFMで新型コロナウイルス スパイクタンパク質の分子ナノ動態を可視化!
金沢大学ナノ生命科学研究所のキイシヤン・リン特任助教とナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らは,同ナノ生命科学研究所の華山力成教授,安藤敏夫特任教授らとの共同研究において,高速原子間力顕微鏡(高速AFM)(※1)を用いることにより,新型コロナウイルスSARS-CoV-2のスパイクタンパク質の分子ナノ動態と,スパイクタンパク質が細胞外小胞(※2)と相互作用する瞬間のナノ動態を可視化することに世界で初めて成功しました(図1)。
新型コロナウイルスが宿主細胞に侵入する際には,まずウイルスのスパイクタンパク質が細胞膜表面にあるアンジオテンシン変換酵素2(ACE2)に結合します。これによりウイルスは宿主細胞膜に結合し,宿主細胞内への侵入が可能となります。今回,研究グループは,スパイクタンパク質と,膜表面にACE2が発現した細胞外小胞(sEV)の間の相互作用を,高速AFMを用いてリアルタイムで可視化しました(図2)。
その結果,スパイクタンパク質の構造の不均一性と,柄の部分であるストークと受容体結合ドメイン(RBD)の柔軟性が明らかとなり,さらにpHや温度によってスパイクタンパク質の構造に変化が生じることがわかりました。特に酸性条件下では,RBDがあるスパイクタンパク質の頭部が開き,かつストーク部分が延びる現象を捉えました。また,ストーク部分がsEVの脂質膜にドッキングし,スパイクタンパク質が持つ融合ペプチドを用いてsEV内に侵入する様子も確認できました。これにより,研究グループは,阻害剤や中和抗体がウイルスに対してどのように働いているのかをリアルタイムで追うことができるプラットホームを示すとともに,ACE2発現sEVが新型コロナウイルスを中和する薬剤となり得ることも示しました。
これらの知見は,コロナウイルスSARS-CoV-2に対するワクチンや新規治療薬の開発に新たな可能性を拓くものです。
本研究成果は,2021年12月7日午前10時(米国東部時間)に国際学術誌『Journal of Extracellular Vesicles』にオンライン掲載されました。
研究の背景
新型コロナウイルス感染症(COVID-19)は,新型β-コロナウイルスであるSARS-CoV-2を原因とするパンデミックであり,多くの国で社会経済的に壊滅的な影響をもたらしています。SARS-CoV-2は,エンベロープに包まれた+鎖RNAをゲノムとするRNAウイルスであり,他のエンベロープ型ウイルスと同様に,宿主細胞内への侵入には膜融合が必要です。このプロセスには,グリコシル化されたホモ三量体のスパイクタンパク質の働きが重要となります。スパイクタンパク質は,球状の頭部 S1サブユニットと,柄のようなS2サブユニットから構成されており,S1サブユニットは宿主の認識をつかさどり,S2サブユニットは膜融合に関与しています。SARS-CoV-2の侵入を阻止し,合成ワクチンや標的薬剤の開発を促進するためには,スパイクタンパク質の構造と動的挙動を解明することが重要ですが,これまで,その詳細な挙動は可視化されていませんでした。
研究成果の概要
本研究では,まずスパイクタンパク質の構造や表面電荷のシミュレーションを行い,高速AFMによる観察に適した条件を見出しました。シミュレーションにより,スパイクタンパク質は秩序化された構造を保ちながらも柔軟なタンパク質であることが予測され,特に,柄のような構造のS2サブユニットは,球状の頭部S1サブユニットよりもさらに柔軟性が高いことが示されました。実際に高速AFMを用いてスパイクタンパク質を観察したところ,S1サブユニットに存在する受容体結合ドメイン(RBD)が閉じた形(クローズ型)と開いた形(オープン型)の両方の存在が明らかになりました。観察対象が不均一なものの集まりの場合でも,高速AFMであればどのタイプも1分子レベルで観察し識別することができます。そのため,さまざまなコンフォメーションを示すスパイクタンパク質の観察には高速AFMが最適であることがわかりました。さらに,最初のシミュレーション通り,S2サブユニットはS1サブユニットよりも動的であることも高速AFMによる動画撮影で明らかになりました。RBDは,S1サブユニットから伸びた触手のような形をしており,動的ではありましたが,S2サブユニットほどではないことも示されました。
次に,pHと温度がスパイクタンパク質の構造に与える影響を調べたところ,酸性条件では,クローズ型のスパイクタンパク質頭部が解離し,さらに柄の部分が伸びて行く様子が高速AFM観察によって捉えられました。さらにこの柄の伸長が,pH依存的な可逆的反応であることもわかりました。また,温度変化によるスパイクタンパク質の構造変化を高速AFMで観察したところ,温度が高くなると,スパイクタンパク質の弾性が変化することも明らかとなりました(図1)。
続いて,脂質に親和性のある融合ペプチドを持つS2サブユニットと,細胞外小胞(sEV)の相互作用を高速AFMで観察しました。これまでの研究でリン特任助教らは,高速AFMを用い,sEVsとA型インフルエンザウイルスのヘマグルチニン(HA)が相互作用し,HAがsEVsの脂質膜に挿入される様子を明らかにしていました。今回,この観察技術を用いることにより,S2サブユニットがsEVsの脂質膜に挿入され,その後sEVsが変形する様子を観察することに成功しました。またこの時,脂質膜の剛性も失われていることを見出しました。これらのことから,S2サブユニットがsEV脂質膜を不安定化していることが明らかとなりました。
宿主細胞が分泌するsEVsはウイルス受容体を発現し,ウイルスに結合することによって,ウイルスを中和して侵入を防ぐことが知られています。そこで,新型コロナウイルス受容体ACE2を発現するsEVsと,スパイクタンパク質の相互作用について検証したところ,スパイクタンパク質はACE2を発現するsEVsと可逆的によく相互作用することがわかりましたが,逆にACE2をあまり発現していないsEVsと相互作用する様子は観察されませんでした(図2)。
これにより研究グループは,ウイルスに阻害剤や中和抗体がどのように働いているのかをリアルタイムで追うことができるプラットホームを示すとともに,ACE2発現sEVsが新型コロナウイルスを中和する薬剤となり得ることを明らかにしました。COVID-19治療薬として,間葉系幹細胞由来のsEVsが臨床試験へと進んでいる現在,これらの知見は,新規治療薬の開発に新たな可能性を拓くものと言えます。
今後の展開
本研究により,高速AFMが,新型コロナウイルスを始めさまざまなウイルスを標的とする種々のアプローチの抑制効果を,直接かつリアルタイムで確認するのに適したアプリケーションであることが示されました。近い将来,新型コロナウイルス,特に今後感染拡大が懸念されるウイルス変異株(「オミクロン株」や「デルタ株」など)のスパイクタンパク質と宿主のACE2との相互作用や,S2サブユニットを介した膜融合を阻害するといった,ウイルスの体内侵入を阻害する効果は,高速AFMによって確認することが可能となることが見込まれます。また本研究グループは,SARS-CoV-2が細胞内に侵入経路を構築して宿主の核膜孔(※3)-細胞質間輸送システムをハイジャックする過程を,高速AFMで可視化することも計画しています。本研究で得られた知見により,高速AFMが,SARS-CoV-2のスパイクタンパク質の挙動を深く知るためのナノイメージングに理想的なツールであることは明らかであり,今後,科学者が効果的な対策(sEVを基本としたワクチンなど)を打ち出す際に重要な役割を果たすことが期待されます。
図1. 新型コロナウイルス感染症(COVID-19)の原因ウイルスであるSARS-CoV-2のスパイクタンパク質(Spike/S)の分子ナノ動態を,世界で初めて直接観察することに成功した。
図2. 概要図:高速AFMによって,コロナウイルススパイクタンパク質がアンジオテンシン変換酵素2(ACE2)と結合する際に起こる相互作用をリアルタイムで直接的に可視化した。
研究者情報
用語解説
掲載論文情報
- 論文タイトル
- Millisecond dynamic of SARS-CoV-2 spike and its interaction with ACE2 receptor and small extracellular vesicles(SARS-CoV-2のスパイクのミリ秒単位の動きと,ACE2受容体や小さな細胞外小胞との相互作用)
- 著者
- Keesiang Lim, Goro Nishide, Takeshi Yoshida, Takahiro Watanabe-Nakayama, Akiko Kobayashi, Masaharu Hazawa, Rikinari Hanayama, Toshio Ando, Richard W. Wong
- 掲載誌
- Journal of Extracellular Vesicles
- 掲載日
- 2021.12.07
- DOI
- 10.1002/jev2.12170
- URL
- https://doi.org/10.1002/jev2.12170