ミトコンドリアへのタンパク質搬入口TOM複合体の精密構造と働く仕組みを解明
金沢大学医薬保健研究域保健学系の荒磯裕平助教(研究当時:京都産業大学タンパク質動態研究所研究員),ナノ生命科学研究所の安藤敏夫特任教授と京都産業大学,東京大学,産業技術総合研究所,宮崎大学,オーストラリア・モナシュ大学,ドイツ・フライブルグ大学の共同研究グループは,クライオ電子顕微鏡を用いた単粒子解析法(※1)により,ミトコンドリア(※2)へのタンパク質搬入口として働くTOM複合体(※3)の精密構造を決定するとともに,TOM複合体を通過した前駆体タンパク質の出口が2つあることを発見しました。
ヒトや酵母などの真核生物の細胞内には,ミトコンドリアをはじめとする膜で仕切られた細胞内小器官が存在します。ミトコンドリアは細胞内で生命活動に必要なエネルギーを産生するため,ヒトではミトコンドリアが正常に機能することが健康につながり,ミトコンドリアの機能低下は老化やさまざまな病態と関連することが知られています。正常に機能するミトコンドリアを維持するためには,性質も機能も異なる1000種に及ぶタンパク質を、前駆体タンパク質(※4)という形で細胞質(外)からミトコンドリア内に膜を通して配送する必要があります。このミトコンドリアへのタンパク質搬入口として働くのが,複数のタンパク質が組み合わさってできたTOM複合体です。しかし,TOM複合体は高分解能の精密構造が決定されておらず,各タンパク質がどのように集合して複合体をつくり,各タンパク質がどのように前駆体タンパク質を効率良く外膜透過させるかなどの問題は未解決でした。
今回,本研究グループは,クライオ電子顕微鏡を用いた単粒子解析法により,TOM複合体の精密構造を3.8Åの高分解能で決定しました。TOM複合体の全体構造は,各サブユニット2個ずつから成る2量体で,タンパク質の通り道である膜透過チャネルとなる円筒形のTom40(※5)同士の界面にTom22が2分子と脂質1分子が入り込んでいることが分かりました。また,タンパク質の膜透過チャネル内に,プレ配列(※6)を持つ前駆体タンパク質と持たない前駆体タンパク質専用の通り道と出口を別々に用意し,出口で待ち構える各輸送経路の下流の因子に前駆体タンパク質を受け渡すことで,性質も機能も異なる1000種に及ぶ前駆体タンパク質の外膜透過を効率良く行っていることが分かりました。
ミトコンドリアへのタンパク質搬入のメカニズムの解明により,ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や,ミトコンドリアへのタンパク質配送の効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
本研究成果は、2019年10月10日16時(英国時間)に英国科学誌「Nature」オンライン版に掲載されました。
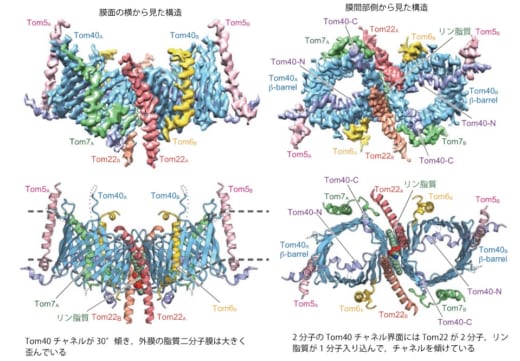
図1. クライオ電子顕微鏡を用いて決定されたTOM複合体の構造
上段は決定構造の構造密度図。下段は構造をリボンモデルで見やすくしたもの。
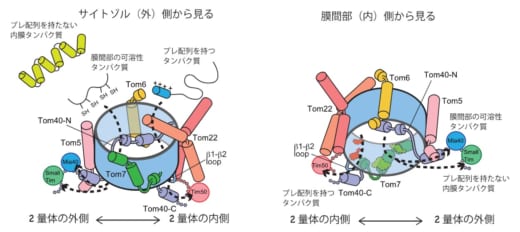
図2. TOM複合体の2つの出口
2量体のうち,1つ分を外側から見たものと,内部側から見たもので示した。出口が2つあることが分かる。
用語解説
掲載論文情報
- 論文タイトル
- Structure of the mitochondrial import gate reveals distinct preprotein paths
- 著者
- Yuhei Araiso, Akihisa Tsutsumi, Jian Qiu, Kenichiro Imai, Takuya Shiota, Jiyao Song, Caroline Lindau, Lena-Sophie Wenz, Haruka Sakaue, Kaori Yunoki, Shin Kawano, Junko Suzuki, Marilena Wischnewski, Conny Schütze, Hirotaka Ariyama, Toshio Ando, Thomas Becker, Trevor Lithgow, Nils Wiedemann, Nikolaus Pfanner, Masahide Kikkawa & Toshiya Endo.
- 掲載誌
- Nature
- 掲載日
- 2019.10.10
- DOI
- 10.1038/s41586-019-1680-7
- URL
- https://doi.org/10.1038/s41586-019-1680-7
Funder
詳しくはこちら

