高速AFMのさらなる高速化・低侵襲化に成功
生体分子プロセスを観察するためのさらに速い高速AFMの開発に成功しました
金沢大学ナノ生命科学研究所の安藤敏夫特任教授と福田真悟特任助教の研究グループは,高速原子間力顕微鏡の新しい走査法を開発することにより,観察速度のさらなる高速化,試料への低侵襲化に成功しました.
本研究成果は2021年3月12日(米国東部時間)に米国物理学協会誌『Review of Scientific Instruments』のオンライン版に掲載されました。
原子間力顕微鏡(AFM)は,カンチレバー,光てこ光学系,スキャナー,振幅計測器,フィードバック制御回路,ピエゾドライバーなどのデバイスからなる顕微鏡です.これらのデバイスの高速化に加え,新しい振動抑制技術やフィードバック制御法の発明により,安藤敏夫特任教授らのグループは実用レベルの高速AFMを2008年に確立しました.試料の高さや脆弱性,イメージング条件にもよりますが,1−12フレーム/秒(fps)の速さで画像を撮ることができるため,高速AFMは生体分子の動的プロセスなどの観察に広く利用されています.しかし,非常に弱い分子間相互作用を介して起こる現象や非常に速く起こる動的プロセスを観察することはできませんでした.さらなる高速化に向けたハードウェアの改良が進められていますが,速度性能をわずか50%改善することでさえ困難な状況にあります.
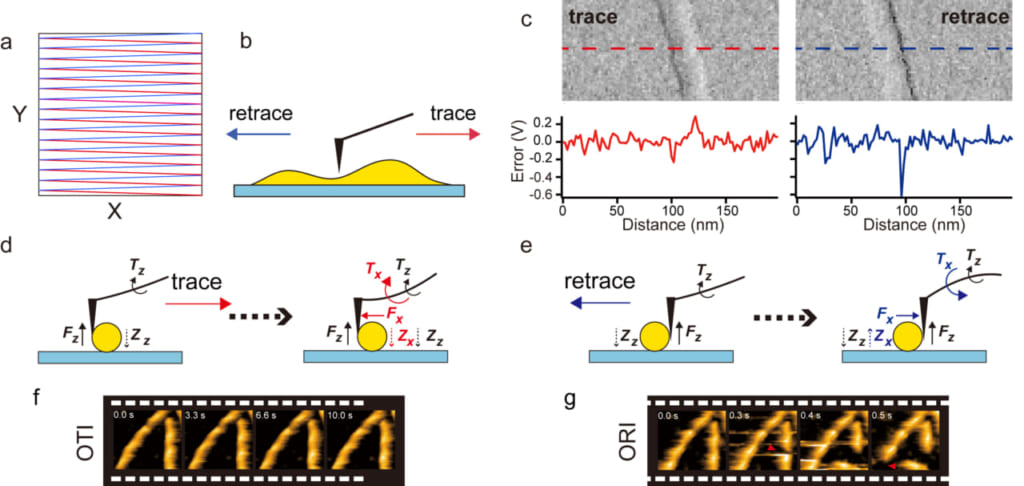
AFMでは,カンチレバー探針が試料と相互作用する位置を順次変えるために,試料ステージ(あるいは,カンチレバー素子)を水平面内でラスター走査します(図1a).相対的に探針は試料表面をY方向にゆっくり進みつつ,X方向に往復走査することになります.また、水平面に投影したカンチレバーの長軸をX方向に一致させます.こうすることにより,探針-試料間接触によりカンチレバーが長軸の周りにねじれるのを防ぎます.探針がカンチレバーの左端に付いているとすると,探針は,往き(トレース走査)では左から右へ,還り(リトレース走査)では右から左に試料表面を走査します(図1b).バイオイメージングで広く利用されている振幅変調モードでは,カンチレバーを上下に振動させますが,トレース,リトレースで得られる2枚の画像はほとんど同じであるため,通常,リトレース像は記録せず,トレース像のみを記録します.しかし,トレース像とリトレース像が本当にほとんど同じであるかは,高速AFMでは正確に調べられていませんでした.
本研究グループはアクチン繊維と微小管を利用し,トレース走査とリトレース走査の比較を行いました.これらのフィラメントがほぼY軸に平行になっているものを選び,X走査時の試料の段差を大きくしてフィードバック制御のエラーが大きくなるようにしました.その結果,意外なことに,急に試料の高さが増大する付近で顕著になるエラーはトレースよりもリトレースで大きいことが確認されました(図1c).この原因を探った結果,リトレース走査では,試料から探針にかかるZ方向の力でカンチレバーに生ずるトルクの向きがX方向の力で生ずるトルクの向きと反対であるのに対し,トレース走査では同じであることが,エラーの差を生む原因であることが明らかになりました(図1d,e).すなわち,リトレース走査の場合,X方向とZ方向の力で生ずるトルクが打ち消し合うため,カンチレバーのたわみは小さくなります.そのため,フィードバック制御が見かけの上ではかかっていても,大きな合力が作用しています.試料の端より先の領域に走査域が移動してX方向の力が小さくなると,トルクの打ち消し合いがなくなり,それまでかかっていた大きなZ方向の力による大きなトルクが現れ,図1c(右)に示すとおり,エラー信号は急に大きくなります.以上の結果に加え,試料の破壊されやすさの測定から,トレース走査はリトレース走査よりも低侵襲性に優れていることが分かりました(図1f,g).
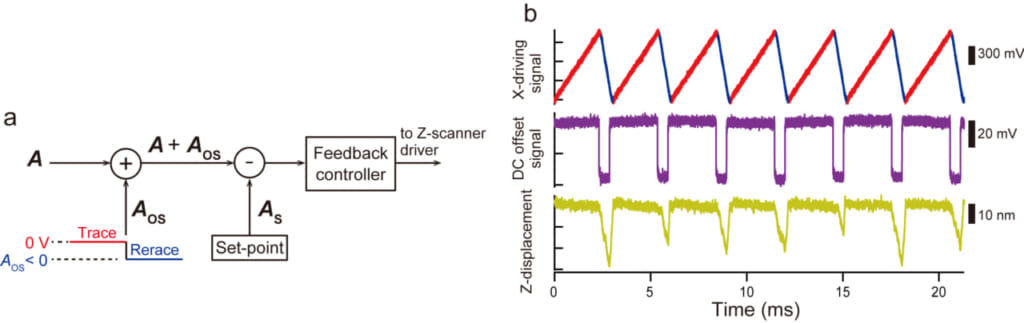
この発見に基づき,本研究グループは”Only trace imaging (OTI)”モードを開発しました(図2a,b).具体的には,リトレース走査時には,試料ステージを探針から遠ざけ探針を試料に接触させず,かつ,トレース走査よりも速く走査することで,低侵襲性が増すだけでなく,X走査にかかる時間を短縮でき,最低でも2倍の高速イメージングが可能となりました.X方向に配向したフィラメント試料の場合には,これまでの走査法に比べOTIモードでは2.5倍高速イメージングできることを確認しました.アクチン繊維では25 fpsで,微小管では30 fpsで試料を壊さずにイメージングできます.また,弱い分子間相互作用で起こるアクチンの重合過程も8 fpsでイメージングできます.OTIモードはこれまでの高速AFMに加算回路を加え(図2a),ソフトウェアプログラムの一部を変更するだけで実現でき,ハードウェアの改良による高速性能の改善が困難な状況にあって,非常に簡単な改変だけで2.5倍の高速イメージングが実現できたことは革新的なことです.OTIモードはすでに特許出願を終えています.
今後の展開
OTIモードは既存の高速AFM装置に容易に組み込むことが可能です。すでに当研究所の高速AFM装置に導入が進んでおり,製品化された高速AFMにもこれから導入されていくに違いありません.スキャナー,振幅計測器,カンチレバーの高速化に向けた改良も徐々に進んでおり,これらの改良とOTIモードを組み合わせると,もろい試料系を50−60 fpsで,丈夫な試料系なら100 fps以上でイメージングできるようになると期待されます.但し,100 fps以上の高速化実現にはXスキャナーの高速化も重要な課題になります.
図1. トレース走査・リトレース走査間の侵襲性の差.(a) 試料ステージのトレース走査(赤線)とリトレース走査(青線)からなるラスター走査.(b) トレース走査とリトレース走査における試料に対する探針の走査方向.(c) ほぼY方向に配向したアクチン繊維のイメージングで生ずるエラーイメージ(上)とエラープロファイル(下)のトレース,リトレース走査での違い.(d, e) 試料から探針に作用するX方向とZ方向の力でカンチレバーに生ずるトルクの向きのトレース走査 (d) とリトレース走査 (e) での違い.(f, g) OTI (f)と”only retrace imaging (ORI)” (g) で,10 fpsで撮ったアクチン繊維の高速AFM像(ORIでは繊維が破壊される).
図2. OTIを導入するために付加された回路と動作.(a) リトレース時にはDCオフセット信号(負の電圧)を振幅信号Aに加算し,探針が試料に強く接触しているかのようにフィードバック制御を動作させ,試料ステージを探針から遠ざける.(b) OTIモードでのXスキャナーのドライブ信号 (上段),DCオフセット信号(中段),及び,Zスキャナーの変位(下段).
掲載論文情報
- 論文タイトル
- Faster High-speed Atomic Force Microscopy for Imaging of Biomolecular Processes (生体分子プロセスを観察するためのさらに速い高速AFM)
- 著者
- Shingo Fukuda and Toshio Ando (福田真悟,安藤敏夫)
- 掲載誌
- Review of Scientific Instruments
- 掲載日
- 2021.03.12
- DOI
- 10.1063/5.0032948
- URL
- https://aip.scitation.org/doi/10.1063/5.0032948