DNAがシャクトリムシダンス?遺伝子が核に収納される第一歩の可視化に世界で初めて成功!
金沢大学大学院新学術創成研究科ナノ生命科学専攻博士前期課程2年/ナノ精密医学・理工学卓越大学院プログラム履修者の西出梧朗,ナノ生命科学研究所のキイシヤン・リン特任助教,ナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らの共同研究グループは,高速原子間力顕微鏡(HS-AFM)(※1)により,ヒストンタンパク質(※2)の一種ヒストンH2AがDNAにより包まれる過程を,ナノスケールかつリアルタイムで可視化することに世界で初めて成功しました。
ヒストンH2A は, ヌクレオソーム(※3)を形成する4種類のヒストンタンパク質の一つで,核内で遺伝情報であるゲノムDNAを凝集させるために重要なはたらきをしています。ヒストンH2A は, アセチル化やメチル化などのヒストン修飾(※4)を受け,DNAの凝集を緩めたり,締めたりすることで,さまざまな遺伝子発現制御に関わっていることが知られています。この働きは膨大な遺伝情報を保持するために重要ですが,ヒストンタンパク質がDNAを包み込むプロセスの詳細についてリアルタイムで実際に観察した例はこれまでにありませんでした。本研究では,HS-AFM を用いて,ヒストンH2A のドメイン構造である球状コアと構造を取らない無秩序なテイルを観察しました。さらに, ヒストンH2A とDNAの相互作用を観察したところ,DNAがシャクトリムシ様の動きをしてヒストンに巻き付く様子を捉えることに成功しました。また,HS-AFM によるDNA-H2A凝集体の観察を行い,DNAとH2Aの間には塩濃度を操作することによって可逆的に変化する液-液相分離(LLPS)(※5) 環境が形成されていることを見いだしました。これらの研究成果により,HS-AFM は,遺伝子発現のオン・オフに関わる重要なDNA-ヒストン結合を制御する因子を見いだすのに適切なツールであることが示されました。加えて, ナノスケールで迅速かつ自発的なLLPS形成を捕捉できることから,タンパク質およびタンパク質-核酸の凝集研究をも実行可能なツールであることが明らかになりました。将来的にはヌクレオソームおよびクロマチン形成過程も,HS-AFMを用いた視覚化が可能になると期待されます。
は,2021 年4 月14 日(米国東海岸標準時間)に米国科学誌『The Journal of Physical Chemistry Letters』のオンライン版に掲載されました。
研究の背景
真核細胞は,DNAの凝縮により,膨大な量の遺伝子情報を1つの区画である核の中に効率的に保存しています。ゲノムDNAはヒストン八量体を包み込んでヌクレオソームを形成し,その後DNAをさらに凝縮させクロマチンを形成しています。これまでに,核内の核膜周縁,特に核と細胞質間の物質輸送を担う核膜の穴=核膜孔の下にクロマチンが凝集している様子が報告されています。クロマチンを形成する各ヌクレオソームは,ヒストン八量体タンパク質をディスクとするその周りに,50 nmのDNA(147 bp)が約1.7周した形をしています。細胞内では,ヒストンH2A,H2B,H3,およびH4のそれぞれ2つのコピーが,正しい順序でDNAに結合するように調節されています。ヌクレオソームは動的であり,部分的にDNAの凝縮を緩めることでヒストンタンパク質が自発的に移動し,遺伝子の発現制御に関わっています。同様に,ヒストン八量体の組成も自由に変わっており,ヒストン八量体内のヒストンの種類の変化は,さまざまな生物学的プロセスを調整していることが明らかとなっています。このように,ヒストンの種類と,DNAとの相互作用は生理学的に重要です。しかし、これまで適したツールが存在しなかったために、DNAがどのような動きをしてヒストンに巻き付き,さらに離れているのかについて,ナノスケールかつリアルタイムで観察できた例はありませんでした。ヒストン修飾による遺伝子発現調節,さまざまな病気や薬剤耐性病変に関係していることが報告されるDNA修復などについて理解を深めるためには,ヒストンを包むDNAのナノ分子動態をよりよく理解することが重要です。
研究成果の概要
本研究では,HS-AFM を用いて,ヒストンH2A のドメイン構造である球状コアと構造を取らない無秩序なテイルを観察しました。さらに,ヒストンH2A とDNAの相互作用を観察し,DNAがシャクトリムシ様の動きをしてヒストンに巻き付く様子を捉えることに成功しました(図1)。また,HS-AFM によるDNA-H2A凝集体の観察では,DNAとH2Aの間には塩濃度を操作することによって可逆的に変化する液-液相分離(LLPS)環境が形成されていることを見いだしました(図2)。
これらの研究成果により,HS-AFM は,遺伝子発現のオン・オフに関わる重要なDNA-ヒストン結合を制御する因子を見いだすのに適切なツールであることが示されました。加えて,ナノスケールで迅速かつ自発的なLLPS形成を捕捉できることから,タンパク質およびタンパク質-核酸の凝集を研究することも実行可能にするツールであることが明らかになりました。
今後の展開
本研究成果により,将来的には4種のヒストンタンパク質によるヌクレオソームおよびクロマチン形成過程も,HS-AFM を用いた視覚化が可能になると期待されます。また,今後,本研究により明らかとなったDNAシャクトリムシ様ダイナミクスは,遺伝子発現に重要なクロマチンの核内時空間ダイナミクスの解明に必要な情報となり得ると考えられます。
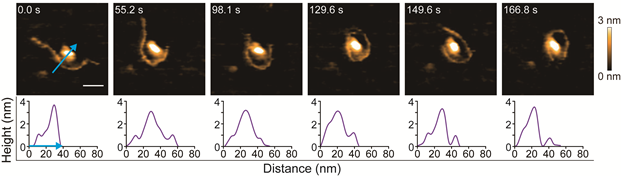
図1. ヒストンH2AがDNAのシャクトリムシ様ダイナミクスによって包み込まれる一連のプロセスを,世界で初めて直接観察することに成功した。拡大画像シーケンスはDNAシャクトリムシ様ダイナミクスによってヒストンH2AがDNAに包み込まれる様子を示す。

図2. HS-AFM によるDNA-H2A凝集体の観察では,DNAとH2A間の塩濃度を操作することによって可逆的に変化する液-液相分離(LLPS)環境が形成されていることが明らかとなった。拡大画像シーケンスは,塩濃度を上昇させるとDNA-H2A凝集体が拡散し,その後塩濃度を減少させるとDNA-H2A凝集体が再び現れることを示している。
用語解説
掲載論文情報
- 論文タイトル
- High-Speed Atomic Force Microscopy Reveals Spatiotemporal Dynamics of Histone Protein H2A Involution by DNA Inchworming (高速AFMを用いたDNAインチワーミングによるヒストンH2Aラッピングの時空間ダイナミクスの解明)
- 著者
Goro Nishide1, Keesiang Lim2, Mahmoud Shaaban Mohamed3, Akiko Kobayashi2,4, Masaharu Hazawa2,4, Takahiro Watanabe-Nakayama2, Noriyuki Kodera2, Toshio Ando2, Richard W. Wong2,4
(西出梧朗1, キイシヤン・リン2,マホモド・シャーバノ・モハンメド2,3,小林亜紀子2,3, 羽澤勝治2,3,中山隆宏2, 古寺哲幸2,安藤敏夫2,リチャード・ウォング1,2,3)
1.金沢大学大学院新学術創成研究科ナノ生命科学専攻博士前期課程,ナノ精密医学・理工学卓越大学院プログラム
2.金沢大学ナノ生命科学研究所
3.金沢大学新学術創成研究機構(研究当時)
4.金沢大学新学術創成研究機構- 掲載誌
- The Journal of Physical Chemistry Letters
- 掲載日
- 2021.04.14
- DOI
- 10.1021/acs.jpclett.1c00697
- URL
- https://pubs.acs.org/doi/10.1021/acs.jpclett.1c00697
Funder
本研究は,文部科学省世界トップレベル研究拠点プログラム(WPI),文部科学省科学研究費補助金(17H05874),日本学術振興会科学研究費助成事業(19K23841, 20K16262, 17K08655),小林国際奨学財団,島津科学技術振興財団,金沢大学新学術創成研究機構ユニット研究推進経費,金沢大学超然プロジェクト,金沢大学「新型コロナウイルス感染症対策支援ファンド」研究費の支援を受けて実施されました。
詳細はこちら
研究者情報 リチャード・ウォング

