精子形成に重要なヒストンによるDNAの新たな折りたたみを解明!
- 精子形成に重要なヒストン(注1)タンパク質H2A.B(注2)によるDNA折りたたみ構造を、高速原子間力顕微鏡(注3)解析により世界で初めて解明しました。
- H2A.Bは“開いた”ヌクレオソーム(注4)構造を取ること、そして主要型のヒストンH2Aと自発的に置き換わることを、発見しました。
- H2A.Bの欠損は精子形成異常に関与することから、この新たな折りたたみのメカニズムの知見は精子形成障害の原因解明や治療法確立へ向けて応用されることが期待されます。
概要
東京大学大学院理学系研究科生物科学専攻の平野里奈 大学院生、東京大学定量生命科学研究所クロマチン構造機能研究分野の胡桃坂仁志 教授らの研究チームは、金沢大学ナノ生命科学研究所の柴田幹大 准教授、京都大学複合原子力科学研究所の杉山正明 教授らとの共同研究で、精子形成に重要なヒストンタンパク質H2A.Bが、DNA折りたたみの基盤構造であるヌクレオソームをダイナミックに構造変換する様子を世界で初めて解明しました。
精子の形成過程では、DNAの折りたたみによって形成される染色体構造が大きく変化していきます。染色体の基本単位であるヌクレオソームは、ヒストンタンパク質がDNAに巻き付くように結合した円盤状の構造体です。精子形成時には、ヒストンバリアント(注5) であるH2A.Bが発現して、染色体におけるDNA折りたたみ構造の変換に重要な役割を果たすと考えられていましたが、H2A.Bの機能については未だ不明な点が多く残されていました。
H2A.Bヌクレオソームの性質の動態を明らかにするためには、解析に必要な大量かつ高純度のヌクレオソームを調製する必要があります。そこで、本研究チームは、精製したヒストンとDNAをもとに、H2A.Bを含むヌクレオソームを試験管内で再構成し、その動態を生化学的解析、高速原子間力顕微鏡解析、そしてX線小角散乱解析(注6)によって解明しました。具体的には、H2A.Bを含むヌクレオソームが、ヒストンの複合体の一部が解離したような“開いた”構造を取ること、そしてH2A.Bが主要型のヒストンH2Aと自発的に置き換わるという特異的な性質を持つことを明らかにしました。これらのことから、H2A.Bを含むヌクレオソームが“開いた”構造を取ることで主要型ヒストンが結合しやすくなり、H2A.Bが押し出されてヒストンが置き換わると考えられました。
本研究で得られた知見は精子形成メカニズム解明に必要不可欠な基盤を提供するものであり、精子形成障害のメカニズムの解明・治療へつながることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP20am0101076)、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)、および国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)の支援を受けて実施されました。
研究の背景・先行研究における問題点
遺伝子DNAは、様々なタンパク質との複合体として高次に折りたたまれることで染色体を形成し、核内に収納されています。染色体は、ヌクレオソームと呼ばれる基本単位が連なって形成されています。ヌクレオソームはヒストンH2A-H2B二量体二つとH3-H4二量体二つからなる複合体にDNAが巻き付いた安定な構造です(図1)。DNA複製期に新たなDNAが合成されると、ヒストンが取り込まれヌクレオソームが形成されます。この時取り込まれるヒストンが主要型ヒストンです。一方、主要型ヒストンとはアミノ酸配列が異なるヒストンの亜種(ヒストンバリアント)が存在し、主要型ヒストンと置き換わりヌクレオソームに取り込まれることで染色体の構造を変化させ、遺伝子の機能発現を適切に制御しています。
精子形成過程において、染色体は大きく構造が変化していきますが、この染色体の構造変換がどのように遂行されるのかについては未だ多くの謎に包まれています。H2A.Bは精子形成時に発現し、欠損すると精子形成障害につながることから、正常な精子形成に重要な役割を果たすと考えられています。しかしH2A.Bが染色体の構造と動態の変化にどのように働くのかについては明らかにされていませんでした。
研究内容
東京大学定量生命科学研究所の胡桃坂仁志 教授らの研究チームは、生化学的解析、高速原子間力顕微鏡解析、そしてX線小角散乱解析を行うことで、H2A.Bを含むヌクレオソーム(H2A.Bヌクレオソーム)の新規の構造と動態を明らかにしました。
研究チームはまず、H2A.Bヌクレオソームを試験管内で再構成し、生化学的解析を行いました。その結果、H2A.Bヌクレオソーム中のH2A.B-H2B二量体が、溶液中に存在する主要型H2A-H2B二量体と自発的に置き換わるという、新規の性質を発見しました(図2)。主要型のヌクレオソーム(H2A-H2B二量体を含んでいるヌクレオソーム)ではヒストンの置き換わりは、ヒストンシャペロン(注7)と呼ばれる特定のタンパク質群によって行われますが、H2A.Bヌクレオソームのヒストン置き換わりはこれらの因子の助けなしに起こる自発的な反応でした。さらに高速原子間力顕微鏡とX線小角散乱による解析から、H2A.Bヌクレオソームは、主要型では見られないヌクレオソームが“開いた”構造を取ることが明らかとなりました(図3)。
これらの二つの発見から、H2A.Bヌクレオソームが“開いた”構造を取ることで、主要型ヒストンが結合しやすくなりH2A.Bが押し出されてヒストンが置き換わると考えられました。
社会的意義・今後の予定
本研究で得られた知見は、精子形成メカニズム解明に必要不可欠な基盤を提供するものであり、精子形成障害のメカニズムの解明・治療へつながることが期待されます。
本研究成果は,2021年2月12日に英国科学誌『Communications Biology』のオンライン版に掲載されました。
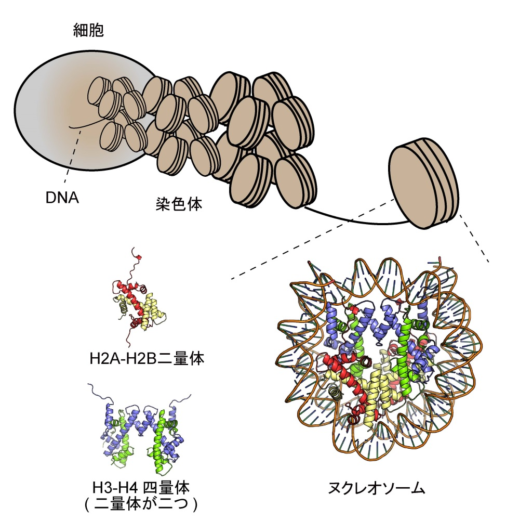
図1. 染色体におけるDNA折りたたみのイメージ図
遺伝子の担体であるDNAは、様々なタンパク質との複合体として高次に折りたたまれることで染色体を形成し、核内に収納されています。染色体は、ヌクレオソームと呼ばれる基本単位が連なって形成されています。ヌクレオソームはヒストンH2A-H2B二量体二つとH3-H4二量体二つからなる複合体にDNAが巻き付いた安定な構造です。
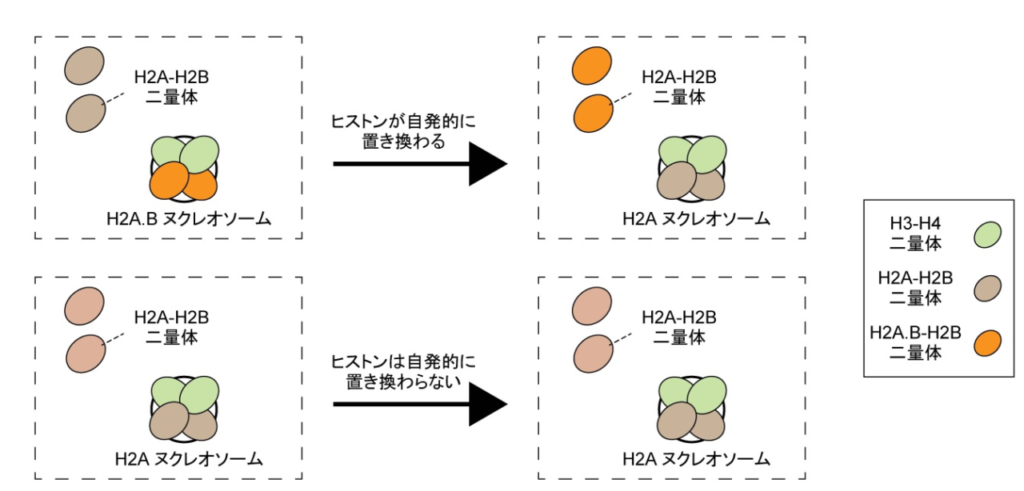
図2. H2A.Bヌクレオソームの自発的にヒストンが置き換わる性質
H2A.Bヌクレオソーム中のH2A.B-H2B二量体が、溶液中に存在する主要型のH2A-H2B二量体と自発的に置き換わるという、新規の動態を発見しました。
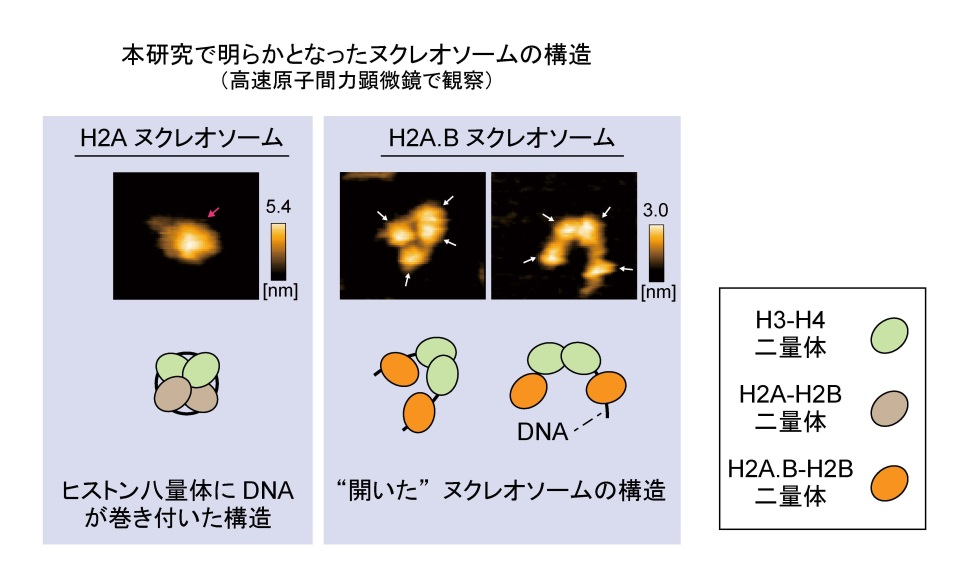
図3. H2A.Bヌクレオソームを高速原子間力顕微鏡で観察した像
高速原子間力顕微鏡による解析から、H2A.Bヌクレオソームは、主要型ヒストンでは見られないヌクレオソームが“開いた”構造を取ることが明らかとなりました。赤および白矢印は、それぞれヒストン八量体および二量体と考えられるものを指しています。高速原子間力顕微鏡像の下に模式図を示しています。
研究者情報
金沢大学ナノ生命科学研究所
准教授 柴田 幹大(シバタ ミキヒロ)
詳しくはこちら
用語解説
掲載論文情報
- 論文タイトル
- Histone variant H2A.B-H2B dimers are spontaneously exchanged with canonical H2A-H2B in the nucleosome
- 著者
- Rina Hirano, Yasuhiro Arimura, Tomoya Kujirai, Mikihiro Shibata, Aya Okuda, Ken Morishima, Rintaro Inoue, Masaaki Sugiyama, and Hitoshi Kurumizaka
- 掲載誌
- Communications Biology
- 掲載日
- 2021.02.12
- DOI
- 10.1038/s42003-021-01707-z
- URL
- https://www.nature.com/articles/s42003-021-01707-z

