肺がん細胞が分子標的薬に抵抗するメカニズムを解明!
金沢大学がん進展制御研究所/ナノ生命科学研究所の矢野聖二教授,がん進展制御研究所/新学術創成研究機構の鈴木健之教授,京都府立医科大学の山田忠明病院准教授らの共同研究グループは,分子標的薬(※1)にさらされた肺がん細胞が,インスリン様増殖因子1受容体(IGF-1R)(※2)のタンパク質量を増やすことにより,抵抗し生き延びることを初めて明らかにしました。
研究の背景
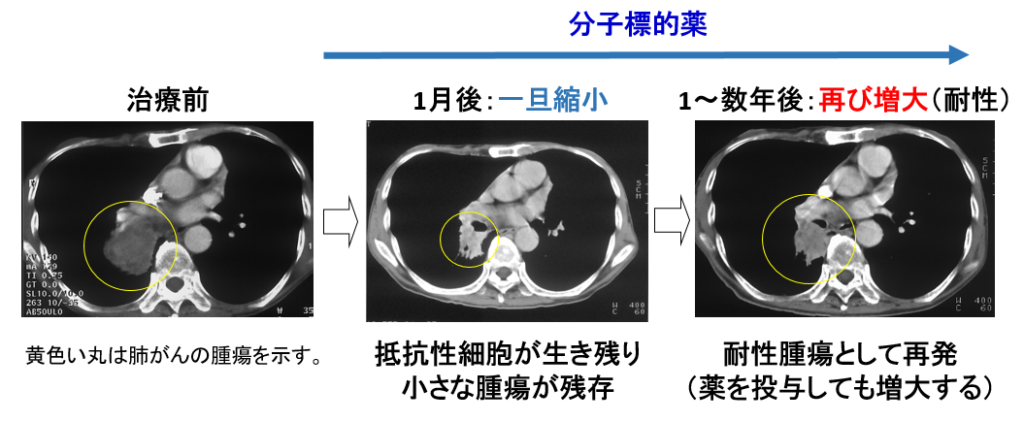
肺がんは,年間約8万人が死亡するわが国のがん死亡原因第一位のがんです。日本人の肺がんの約20%は,上皮成長因子受容体(epidermal growth factor receptor: EGFR)という遺伝子の変異が原因の肺がん(EGFR変異肺がん)で,その頻度は欧米人(10%以下)よりも高いのが特徴です。EGFR変異肺がんは変異したEGFRからの生存シグナルで増殖しており,変異EGFRの機能を抑えるオシメルチニブ(※5)という分子標的薬が有効です。オシメルチニブは,約8割のEGFR変異肺がんに劇的に効いて腫瘍を一旦小さくしますが,一部のがん細胞が抵抗性細胞として生き残り,1年から数年後に耐性のがんとして再発することが問題になっています(図1)。
本研究グループは,これまでに,EGFR変異肺がんのうちAXL(アクセル,※6)というタンパク質を多く発現したがん細胞はオシメルチニブが効きにくく,その原因はAXLが生存シグナルを補うことで抵抗性細胞を生み出し,耐性の温床になることを報告していました(Nature Communications, 2019) (図2)。
研究成果の概要
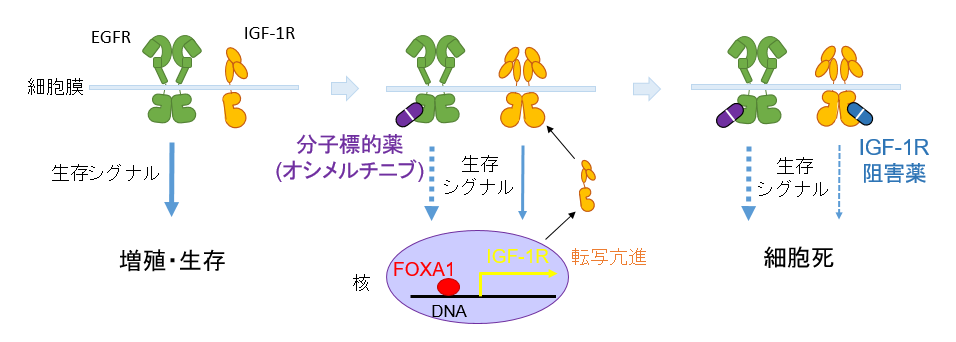
本研究では,AXL低発現のEGFR変異肺がんについて解析し,分子標的薬オシメルチニブにさらされた腫瘍細胞の一部が抵抗し生き残るメカニズムを解明しました(図3)。
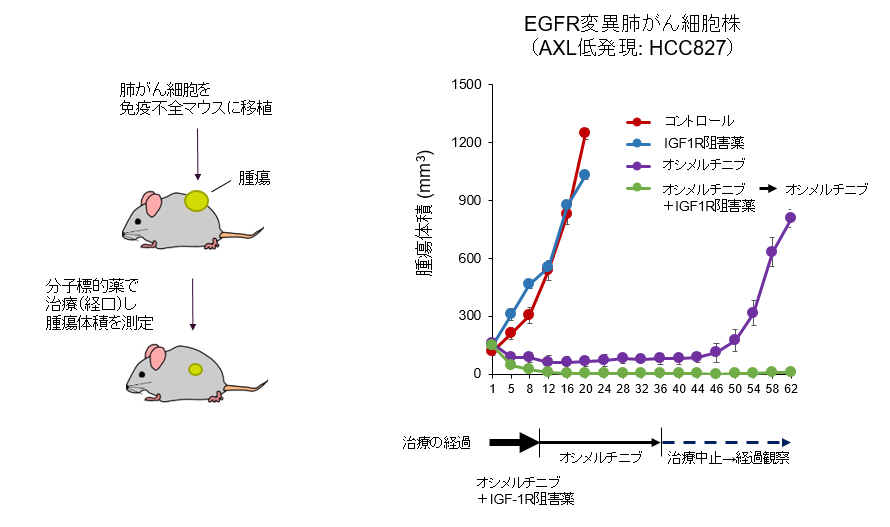
AXL低発現のEGFR変異肺がん細胞は,1)オシメルチニブが効きやすいものの,やはり一部のがん細胞が抵抗性細胞として生き残り,最終的には耐性がんとして再発してしまいました。そのメカニズムとしては,2)インスリン様増殖因子1受容体(insulin-like growth factor-1 receptor: IGF-1R)のタンパク質量を増やし,増えたIGF-1Rが生存シグナルを補うことで,がん細胞の一部が抵抗性細胞として生き延びていました。さらに,3)抵抗性細胞ではオシメルチニブ処理に応答して,転写因子(※7)であるFOXA1(※8)がIGF-1Rの転写を亢進してIGF-1Rのタンパク質量を増やすことを発見しました。4)動物モデルでは,オシメルチニブに短期間(動物モデルでは40日間治療のうちの10日間)IGF-1R阻害薬を併用することで腫瘍を消失させ,治療を止めても再発をほぼ完全に防げることを明らかにしました(図4)。
IGF-1Rはこれまでにもがん治療の標的と考えられてきましたが,インスリン受容体と非常に形が似ているため,薬で長期間IGF-1Rを阻害しようとするとインスリン受容体まで阻害してしまい,生体の糖代謝に重要なインスリンの働きを狂わせるため,大きな副作用が出ることが問題でした。本研究では,分子標的薬にIGF-1R阻害薬を短期間併用することで,大きな副作用なく腫瘍をほぼ根治できることを見いだしました。
また,抵抗性細胞が生き残るにはFOXA1という転写因子が働いてIGF-1Rのタンパク質量が増える必要があることを明らかにしました。従って,FOXA1の働きを阻害する薬を開発できればインスリン受容体には作用せず,IGF-1Rのみを阻害し分子標的薬の効果を増強できる可能性があります。
今後の展開
本研究成果により,AXL低発現のEGFR変異肺がん患者に,治療当初から短期間IGF-1R阻害薬を分子標的薬に併用することで,腫瘍を消しきり,根治あるいは再発までの期間を劇的に伸ばすことが期待されます。また,FOXA1の機能を抑制する薬剤はインスリン受容体には影響せずIGF-1Rのみを抑制できる可能性があり,今後FOXA1阻害薬の開発を目指します。
用語解説
掲載論文情報
- 論文タイトル
- Transient IGF-1R inhibition combined with osimertinib eradicates AXL-low expressing EGFR mutated lung cancer (オシメルチニブと一過性のIGF-1R阻害の併用はAXL低発現のEGFR変異肺がんを根絶する)
- 著者
- Rong Wang, Tadaaki Yamada, Kenji Kita, Hirokazu Taniguchi, Sachiko Arai, Koji Fukuda, Minoru Terashima, Akihiko Ishimura, Akihiro Nishiyama, Azusa Tanimoto, Shinji Takeuchi, Koshiro Ohtsubo, Kaname Yamashita, Tomoyoshi Yamano, Akihiro Yoshimura, Koichi Takayama, Kyoichi Kaira, Yoshihiko Taniguchi, Shinji Atagi, Hisanori Uehara, Rikinari Hanayama, Isao Matsumoto, Xujun Han, Kunio Matsumoto, Wei Wang, Takeshi Suzuki, Seiji Yano (Wang Rong,山田 忠明,北 賢二,谷口 寛和,新井 祥子,福田 康二,寺島 農,石村 昭彦,西山 明宏,谷本 梓,竹内 伸司,大坪 公士郎,山下 要,山野 友義,吉村 彰紘,高山 浩一,解良 恭一,谷口 善彦,安宅 信二,上原 久典,華山 力成,松本 勲,Han Xujun,松本 邦夫,Wang Wei,鈴木 健之,矢野 聖二)
- 掲載誌
- Nature Communications
- 掲載日
- 2020.09.14
- DOI
- 10.1038/s41467-020-18442-4
- URL
- https://www.nature.com/articles/s41467-020-18442-4
Funder
詳細はこちら