細胞分化パターンを人工的に設計できる 細胞間シグナル伝達モデル「人工モルフォゲン」 の開発に成功!
金沢大学ナノ生命科学研究所の戸田聡助教,カリフォルニア大学サンフランシスコ校のWendell Lim教授らの国際共同研究グループは,任意のタンパク質を細胞間シグナル伝達分子へと変換する技術を開発し,細胞分化パターンを人工的に設計できる細胞間シグナル伝達モデル「人工モルフォゲン」を構築することに成功しました。
研究の背景
動物の発生過程では,発生を誘導するオーガナイザーの役割を果たす細胞からシグナル分子が分泌され,胚の中を拡散し,周囲の細胞の運命決定を導く道標・位置情報として作用することが知られています。このような細胞間シグナル分子はモルフォゲンと呼ばれ,胚の中のどこの細胞が将来,脳や血管など,どの臓器の細胞に分化するかを制御しています。これまで,モルフォゲンが位置情報を形成するメカニズムについて多くの研究がなされてきましたが,さまざまな分子が相互作用する動物胚の中では,分泌されたモルフォゲンの挙動は複雑に制御され,その仕組みを逐一解析することは困難です。そこで,胚の中でのモルフォゲンによるパターン形成過程を解析する研究とは逆の発想で,本研究は,モルフォゲンとは無関係な分子,例えば,緑色蛍光タンパク質GFPを用いて,GFPの受容と応答による人工的な細胞間シグナルを一から構築し,新たな細胞分化パターンを形成することを目指しました。
研究成果の概要
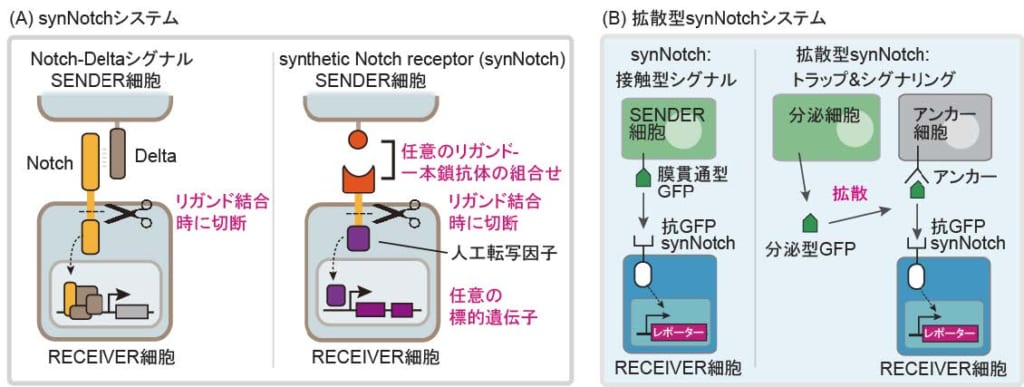
本研究では,マウス線維芽細胞株を用いて,GFPを分泌する細胞と,GFP nanobodyと膜貫通ドメインを融合したアンカー分子を発現することで,GFPを受け取ることができる細胞を作製しました。さらに,ただGFPを受け取るだけではなく,細胞にシグナルを入れて細胞分化を制御するため,近年,合成生物学(※3)分野で開発された人工受容体synthetic Notch receptor(synNotch)を利用しました。synNotchはNotch受容体をもとに作られたキメラ受容体で,隣り合った細胞間で,互いの遺伝子発現を制御する細胞間相互作用を構築することが可能です(図1A)。例えば,GFP nanobodyを細胞外に持つ抗GFP synNotchは,隣接細胞が発現する膜貫通型GFP(GFPと膜貫通ドメインの融合タンパク質)を認識すると,物理的な張力により構造変化を引き起こして活性化し,標的遺伝子を誘導することができます(図1B)。しかし,分泌型GFPはsynNotchに結合しても構造変化を誘導できず,synNotchを活性化することはできません。そこで,分泌されたGFPをアンカー分子により細胞表面にトラップし,それをsynNotchが認識することで,分泌型GFPによるsynNotchの活性化を実現しました(図1B)。この拡散型synNotchにより,液中を拡散するタンパク質によってsynNotchを活性化して遺伝子発現および細胞分化を誘導することが可能となりました。
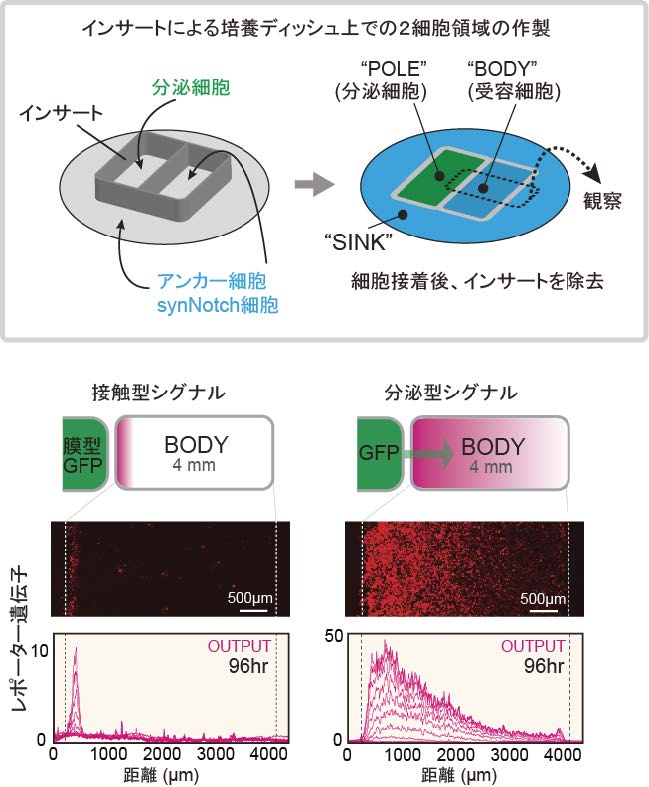
分泌されたGFPによるシグナルを観察するため,培養ディッシュ上に,GFP分泌細胞から成る「POLE」領域とGFPを受容するアンカー細胞・synNotch細胞から成る「BODY」領域を形成しました(図2)。膜貫通型GFP発現細胞をPOLE領域に蒔いた場合,BODY領域との境界のみでレポーター遺伝子(※4)が誘導されるのに対し,GFP分泌細胞を蒔いた場合は,分泌型GFPが拡散により長距離にわたって濃度勾配を形成し,レポーター遺伝子発現の勾配が誘導されました(図2)。さらに,GFPに限らず,細胞が分泌したタンパク質は,細胞表面にトラップされてsynNotchにより認識されることで,モルフォゲンのように拡散して遺伝子発現を制御できることを見いだしました。そこで,このシステムを「人工モルフォゲン」と名付けました。さらに,人工モルフォゲンが形成するシグナル勾配の振幅や伝達距離は,アンカー分子の密度や人工モルフォゲン活性を阻害するnanobody(阻害抗体)によって調節可能であることを見いだしました。
今回開発した人工モルフォゲンシステムは,
- 人工モルフォゲンの受容体との親和性や発現量などさまざまなパラメーターを設計可能
- synNotchを用いて遺伝子発現を誘導するため,望みの標的遺伝子を誘導可能
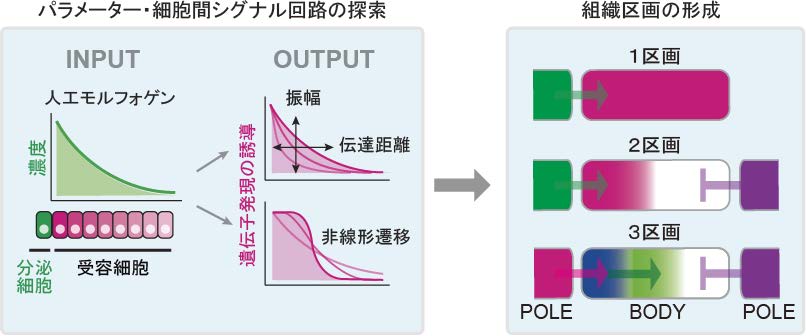
という非常に自由度の高いシステムであり,パラメーター探索によるシグナル勾配の制御に加えて,人工モルフォゲンを受容した細胞自身がそのシグナルを増強あるいは阻害するフィードバック回路を構築することも可能です。さらに,人工モルフォゲンおよび阻害抗体を用いることで,動物胚で見られる,胚の両極からモルフォゲンおよびモルフォゲン阻害分子が分泌されて形成される細胞分化パターンを培養ディッシュ上で再現することも可能です。以上の特徴を利用して,細胞間シグナル回路を構築することにより,異なる遺伝子発現を誘導する複数の組織区画を形成することに成功しました(図3)。
人工モルフォゲンは,内在的な細胞間シグナル経路には干渉しない独立したシンプルな細胞間シグナル系にもかかわらず,生体外においてシグナル勾配や組織区画を十分に形成することができました。よって,人工モルフォゲンを生体内に導入して細胞分化を空間的に操作するツールとしての応用が期待されます。実際に,フランシスクリック研究所(Francis Crick Institute)のJean Paul Vincent博士らの研究グループは,モルフォゲン Dpp(Decapentaplegic)(※5)を人工モルフォゲンGFPと置換し,Dpp受容体にGFP nanobodyを融合してGFPを認識する人工受容体へと改変しました。その結果,分泌されたGFPがショウジョウバエの羽の発生を誘導できることを見いだしました。このショウジョウバエを用いた生体内での人工モルフォゲンGFPの解析に関する研究も,同誌に「Patterning and growth control in vivo by an engineered GFP gradient」として同時掲載されました。
今後の展開
人工モルフォゲンは,内在的な細胞間シグナル経路に影響を与えることなく,さまざまなパラメーター(人工モルフォゲンの受容体との親和性や発現量,誘導する遺伝子など)を自在に設計可能です。よって,これまでに提唱されたパターン形成理論を実際に再構築して検証するツールとして有用であると同時に,組織内で新たな細胞分化パターンを形成し,異種細胞の配置を制御することで臓器機能をデザインする組織工学への応用が期待されます。さらに,任意のタンパク質を細胞間シグナル分子に変換することができるため,病変組織から放出される疾患関連因子を病変の位置を示すシグナルとして検出する細胞の作製が可能です。将来,細胞をロボットのように改変し,体内の病変組織を見つけ出して,必要な場所で必要な応答を出力する細胞医薬を開発することで,正確にプログラムされた再生医療の実現が期待されます。
(A)synNotch システム。細胞間シグナル伝達分子であるNotch 受容体は,リガンドの膜タンパク質Delta を認識すると,物理的な張力により構造変化し,細胞膜付近でプロテアーゼにより切断され,細胞内ドメインが核へ移行,遺伝子発現を誘導します。synNotch は,Notch膜貫通ドメインを保持したまま,Notch 細胞外ドメインを任意の抗原・リガンドを認識する一本鎖抗体に置換し,さらに,細胞内ドメインを人工転写因子に置換したキメラ受容体です。これにより,synNotch は任意のリガンドを認識して任意の遺伝子の発現を誘導することができ,細胞の受容と応答を自在にプログラムすることができます。
(B)拡散型synNotchシステム。抗GFP synNotchは膜貫通型GFPによって活性化されますが,分泌型GFPでは活性化されません。そこで,分泌型GFPをアンカー分子によって細胞表面にトラップし,GFP上の異なるエピトープを認識する抗GFP synNotchに提示することで,分泌型GFPによるsynNotch活性化が誘導されます。
培養ディッシュ上にインサートを置き,左側にGFP分泌細胞,右側にアンカー細胞・synNotch細胞を蒔くことにより,GFPを分泌する「POLE」領域とGFPを受容する「BODY」領域を形成しました。膜貫通型GFP発現細胞をPOLE領域に蒔いた場合,領域境界上の細胞のみが活性化しましたが,分泌型GFP発現細胞を蒔いた場合,BODY領域内をGFPが拡散して濃度勾配を形成することにより,遺伝子誘導のシグナル勾配が形成されました。グラフ内の各線は12時間毎のレポーター遺伝子の発現強度を示しています。
人工モルフォゲンシステムでは,人工のシステムがゆえに,人工モルフォゲンと受容体の親和性や発現量などのパラメーターの網羅的な探索や,人工モルフォゲンに応答してそのシグナルを増強あるいは阻害する細胞間フィードバック回路の構築が可能です。これにより,モルフォゲンシグナル勾配の振幅や伝達距離の制御や,モルフォゲン濃度勾配を非線形に読み取る細胞間シグナル回路の構築など,細胞分化の位置制御原理の探索に利用できます。また,これらの知見を組み合わせることで,人工モルフォゲンを受容するBODY領域において,異なる遺伝子発現を誘導する組織区画を形成することができます。
用語解説
掲載論文情報
- 論文タイトル
- Engineering Synthetic Morphogen Systems that Can Program Multicellular Patterning (細胞分化パターンの設計が可能な人工モルフォゲンシステムの開発)
- 著者
- Satoshi Toda,Wesley L. McKeithan,Teemu J. Hakkinen,Pilar Lopez,Ophir D. Klein,Wendell A. Lim (戸田 聡,Wesley L. McKeithan,Teemu J. Hakkinen,Pilar Lopez,Ophir D. Klein,Wendell A. Lim)
- 掲載誌
- Science
- 掲載日
- 2020.10.15
- DOI
- 10.1126/science.abc0033
- URL
- https://science.sciencemag.org/content/370/6514/327
Funder
詳しくはこちら