ビタミン代謝物を迅速定量できる超分子バイオセンサーを開発!
金沢大学ナノ生命科学研究所の生越友樹特任教授/京都大学大学院工学研究科教授,金沢大学がん進展制御研究所/ナノ生命科学研究所の上野将也助教,平尾敦教授らの研究グループは,生体試料中のビタミン代謝物を迅速に定量できる超分子バイオセンサー(水溶性ピラー[6]アレーン(P6A))(※1)を開発しました。
研究の背景
食物から取り込まれたアミノ酸,糖質,核酸,脂肪,ビタミンなどの栄養素は,体内のさまざまな酵素によって分解や化学的修飾を受けて代謝され,体内では非常に多種多様な代謝物が作り出されます。それぞれの代謝過程は,栄養素の摂取量や排泄量,エネルギーの蓄積量や消費量などさまざまな生理状態に応じて綿密に制御されています。一方,メタボリックシンドロームと呼ばれる症候群が知られており,この患者では,内臓脂肪型肥満,高血糖,高血圧,脂質異常などの代謝異常がみられます。従って,多様な代謝物を含む生体試料(尿や血液など)から,特定の代謝物を正確に測定することは,診断や治療において極めて重要です。
食事制限などにより体内のニコチンアミド(ビタミンB3の一種)(※2)が欠乏すると,皮膚炎,下痢,認知症症状を主徴とした“ペラグラ”を引き起こすことが知られています。体内でニコチンアミドは,ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の生合成に使われると同時に, NNMT(※3)と呼ばれる代謝酵素によって1-メチルニコチンアミド(1-MNA)になり尿中へ排泄されます(図1)。一部の1-MNAは,さらにアルデヒドオキシダーゼによって酸化され,2py(N1-メチル-2-ピリドン-5-カルボキサミド)あるいは4py(N1-メチル-4-ピリドン-3-カルボキサミド)という物質になります。最終的に1-MNA,2py,および4pyはいずれも尿中に排泄されます。従って,尿中の1-MNA濃度を測定すれば,患者体内のニコチンアミド量を推測することができます。
一方で,最近の研究から,NNMTはさまざまながんで発現が亢進しており,がんの進展や悪性化にNNMTが関与していることが明らかになってきました。NNMTを抑制することで,いくつかのがん細胞株の増殖を抑制できることが報告されており,がん細胞のNNMTを阻害できれば,がんを抑制できる可能性があります。しかし,NNMT阻害剤の開発には,数万種類の候補から,1-MNA産生を抑制する化合物を同定する必要があります。通常,1-MNAのような低分子量の代謝物測定には非常に高価な質量分析計と,その扱いに熟練したオペレーターが不可欠であり,さらに測定時間が長いため大規模スクリーニングには適していません。従って,特定の代謝物を認識できる“バイオセンサー”の開発は,迅速な代謝物測定方法開発のブレークスルーとなります。
研究成果の概要
今回,1-MNAの簡便な測定方法を開発する目的で,がん生物学(上野,平尾ら)と超分子化学(生越ら)の研究者らが共同研究を行い,水溶性ピラー[6]アレーン(P6A)(※1)が1-MNAと特異的に結合し,この結合によりP6Aの蛍光が消光することを発見しました。P6Aは生越らの研究グループによって最初に報告された超分子化合物“ピラーアレーン”が1-MNAのような分子サイズの陽イオン分子と結合するように設計した化合物で,1,4-ジアルコキシベンゼンがパラ位で結合した柱型環状化合物から合成されます(図2)。ピラーアレーンは分子中央の電子豊富な空洞を持ち,その空洞サイズの適した陽イオン分子と安定した錯体を形成することが知られています。研究グループはプロトン核磁気共鳴(1H NMR)および等温滴定型カロリメトリー(isothermal titration calorimetry)解析から,P6Aは1:1の割合で1-MNAと安定な錯体を形成することを発見しました(検出限界は4.38×10-6 M)。P6Aの結合は高い選択性があり,化学構造が非常に類似しているニコチンアミドや2pyとはほとんど結合しないことを明らかにしました(図3)。さらに研究グループは,NNMTの無細胞反応系や, Nnmt欠損マウス(※4)を用いた解析から,P6Aは夾雑物が含まれる酵素反応液や尿試料中でも1-MNAと特異的に結合し,1-MNA濃度に依存して蛍光が消光することを発見し,非常に簡便である上に,質量分析計を用いた従来法と同等の結果が得られることを確認しました(図4)。
今後の展開
これらの知見は,NNMT阻害剤の大規模スクリーニングや,メタボリックシンドローム患者や,がん患者の迅速診断に活用されることが期待されます。さらに,がん細胞の表層や内部の代謝物を直接観ることができるナノプローブの開発や,がんの診断や治療に有用な全く新しいバイオセンサー開発への応用が期待されます。
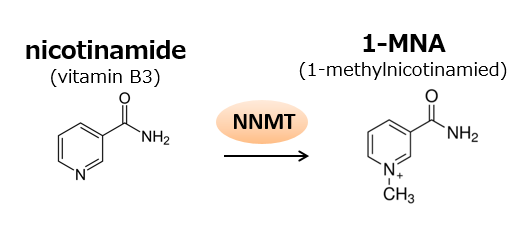
図1.ニコチンアミドはNNMTによって1-メチルニコチンアミド(1-MNA)に代謝され,尿中へ排泄される。
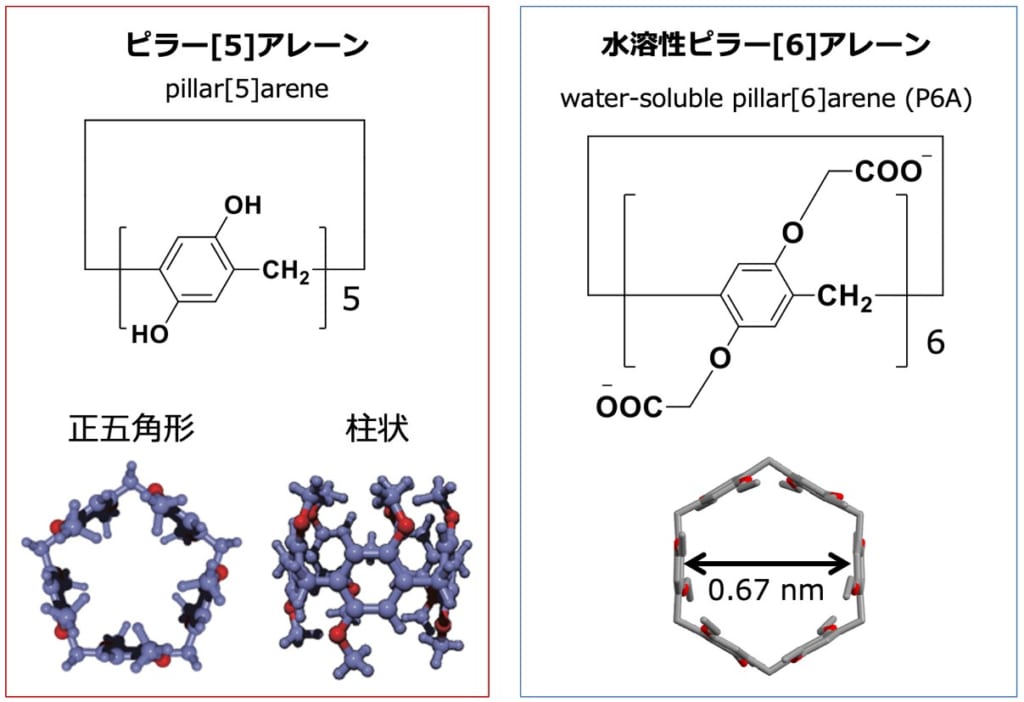
図2.ピラー[5]アレーンは生越らの研究グループによって初めて合成に成功した超分子化合物で,1,4-ジアルコキシベンゼンがパラ位で結合した柱型環状構造を有している。水溶性ピラー[6]アレーン(P6A)は1-MNAのような分子サイズの陽イオン分子と結合するように設計した化合物で,分子内に12個のカルボキシ基を持つ。ピラーアレーンは分子中央の電子豊富な空洞を持ち,陽イオン分子と安定した錯体を形成する。
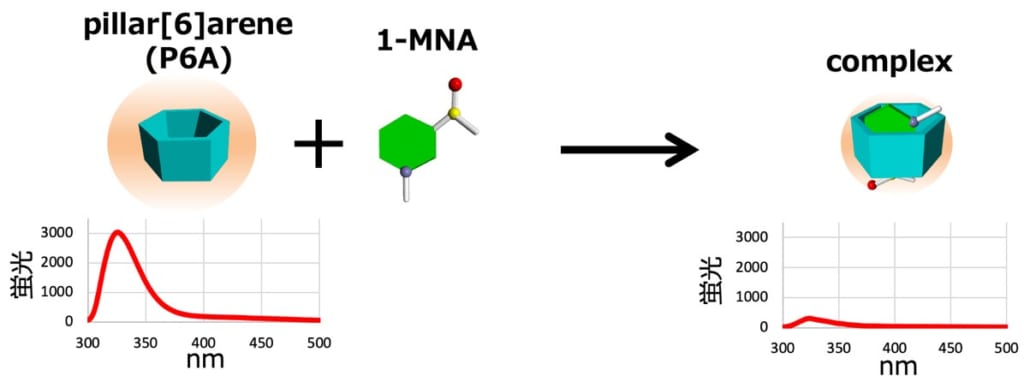
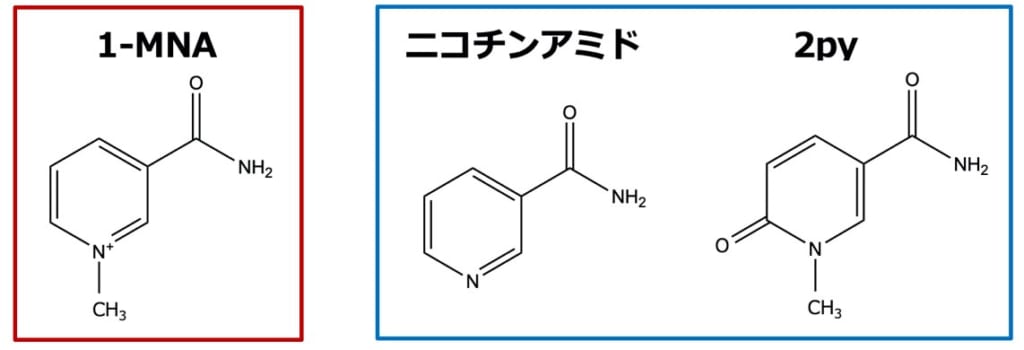
図3.水溶性ピラー[6]アレーン(P6A)は1-MNAと特異的に結合し,この結合によりP6Aに由来する蛍光が消光することを発見した。さらにP6Aは化学構造が類似しているニコチンアミドあるいは2pyとは結合しないことも発見した。
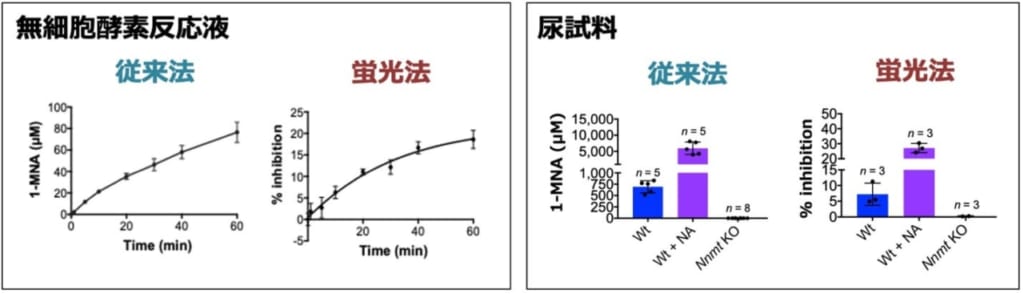
図4.無細胞酵素反応液では,NNMTの酵素反応により時間依存的に1-MNAが産生される。また,摂取されたニコチンアミドはNNMTにより1-MNAに代謝され,1-MNAは尿中に排泄される。そのため野生型マウス(Wt)にニコチンアミド を過剰摂取させると(Wt + NA),1-MNAの尿中排泄量は著しく上昇する。一方,Nnmt欠損マウスでは体内のNNMT酵素が完全に欠損しているため,1-MNAは全く検出されない。上記のような夾雑物が含まれる検体中でも,P6Aは1-MNAと特異的に結合できるため,蛍光値を測定するだけで1-MNAを定量でき,非常に簡便である上に,質量分析計を用いた従来法と同等の結果が得られた。(従来法:質量分析計の測定結果。蛍光法:P6Aを用いた測定結果。無細胞反応液:精製したNNMTと基質を混合し,37℃で反応させたもの。尿試料:マウスから採尿したサンプル。)
用語解説
掲載論文情報
- 論文タイトル
- Pillar[6]arene acts as a biosensor for quantitative detection of a vitamin metabolite in crude biological samples (ピラー[6]アレーンは未精製生体サンプルに含まれるビタミン代謝物を定量的に検出するバイオセンサーとして機能する)
- 著者
- Masaya Ueno, Takuya Tomita, Hiroshi Arakawa, Takahiro Kakuta, Tada-aki Yamagishi, Jumpei Terakawa, Takiko Daikoku, Shin-ichi Horike, Sha Si, Kenta Kurayoshi, Chiaki Ito, Atsuko Kasahara, Yuko Tadokoro, Masahiko Kobayashi, Tsutomu Fukuwatari, Ikumi Tamai, Atsushi Hirao, Tomoki Ogoshi (上野 将也,富田 卓弥,荒川 大,角田 貴洋,山岸 忠明,寺川 純平,大黒 多希子,堀家 慎一,司 沙,倉吉 健太,伊藤 千秋,笠原 敦子,田所 優子,小林 昌彦,福渡 努,玉井 郁巳,平尾 敦,生越 友樹)
- 掲載誌
- Communications Chemistry
- 掲載日
- 2020.12.07
- DOI
- 10.1038/s42004-020-00430-w
- URL
- https://doi.org/10.1038/s42004-020-00430-w
Funder
詳しくはこちら

