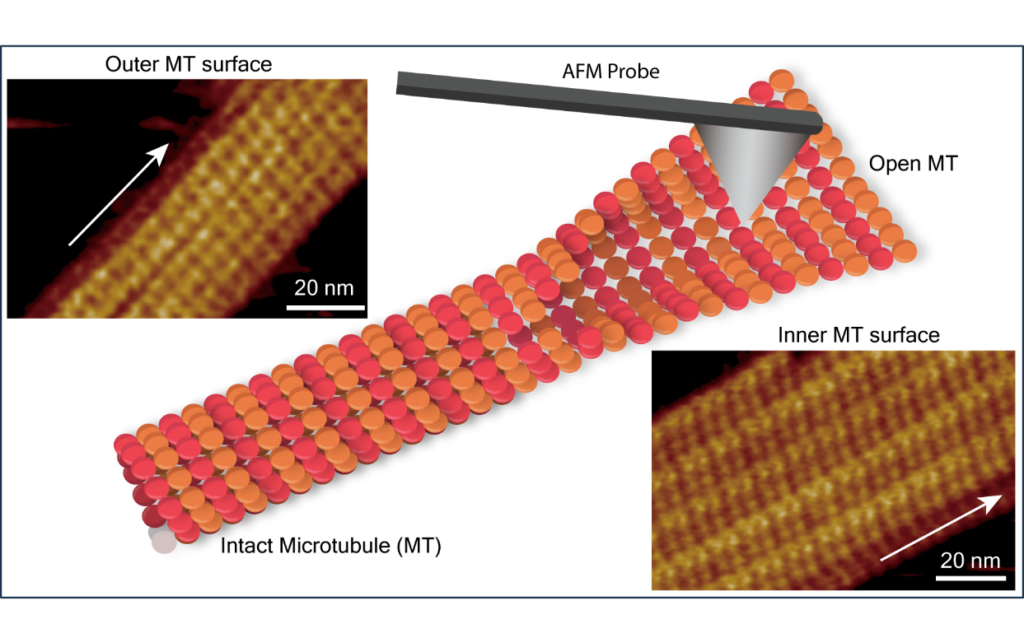
微小管内側構造の高分解能観察に成功!
金沢大学ナノ生命科学研究所(WPI-NanoLSI)のアイハン・ユルトセベル特任助教、福間剛士教授、理工研究域物質化学系/WPI-NanoLSIの淺川雅教授らの研究グループは、広島大学の池上浩司教授、浜松医科大学の瀬藤光利教授らと共同で、細胞骨格である微小管の内側構造を原子間力顕微鏡で高分解能観察し、生体機能に関わる微細構造を可視化することに成功しました。
主要な細胞骨格である微小管は、細胞分裂や細胞内輸送などの細胞プロセスで重要な役割を果たします。主にα-チューブリンとβ-チューブリンと呼ばれる2種類の球状タンパク質で構成されており、α-、β-チューブリンヘテロ二量体が基本単位となります。それらが直線的に重合することでプロトフィラメントと呼ばれる集合体となり、それが最終的に円筒形の微小管を形成します。微小管の内側には、抗がん剤の結合部位などの重要な微細構造が存在するため、高分解能での構造解析が期待されていました。しかし、これまで生理学的条件下で微小管の内側構造を高分解能観察することはあらゆる分析手法を用いても非常に困難でした。
そこで本研究では、液中でサブナノメートル分解能を有する周波数変調原子間力顕微鏡(FM-AFM、※1)を用いて、これらの技術課題を打破しました。微小管が円筒形からシート状集合体へ構造変化することを利用し、微小管の生体機能に関わる継ぎ目構造(seam line)や構成タンパク質の欠陥構造に加えて、抗がん剤として用いられるタキソールの結合を直接観察することに成功しました。
これらの知見は、さまざまな細胞プロセスにおける微小管の役割についてより深く理解することに繋がり、それらが関わるがんなどの疾患に対して、より特異的で効率的な新薬の開発に貢献することが期待されます。
本研究成果は、2024年11月21日(米国東部時間)に米国科学誌『Nano Letters』のオンライン版に掲載されました。また本誌の表紙(Front Cover)に採用されています。
研究の背景
主要な細胞骨格である微小管は、細胞分裂・細胞内輸送などの細胞プロセスで重要な役割を果たします。微小管は主にα-チューブリンとβ-チューブリンの2種類の球状タンパク質で形成され、α-、β-チューブリンヘテロ二量体を基本単位として直線的に重合することでプロトフィラメントと呼ばれる集合体が形成され、最終的に円筒形の微小管が形成されます。X線結晶構造解析やクライオ電子顕微鏡などの従来の分析手法で、微小管構造に関する理解は進展していましが、複雑なサンプル準備とデータ分析が必要でした。また生理学的条件下で、タンパク質1分子よりも高い解像度で微小管の構造的特徴、形成ダイナミクス、欠陥構造を調べることができる計測技術もありませんでした。
研究成果の概要
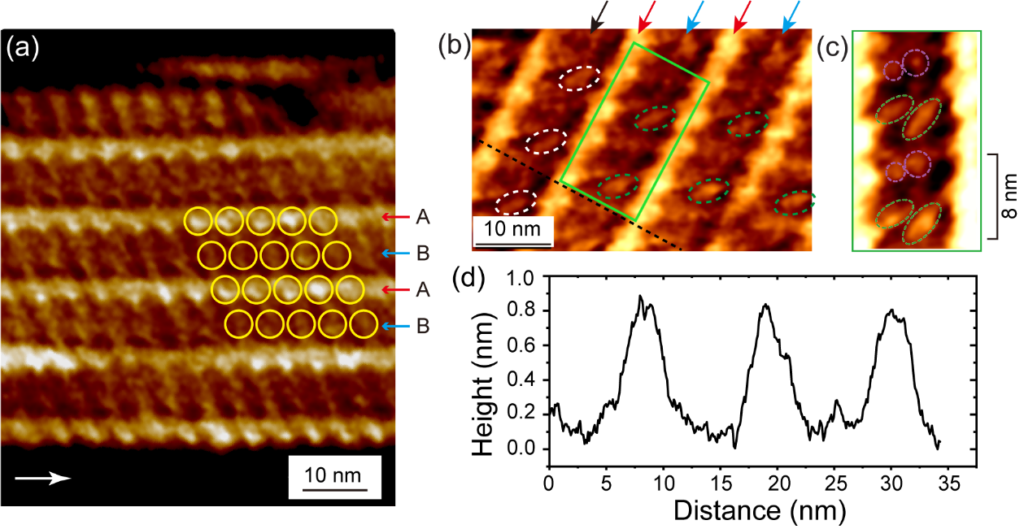
円筒形の微小管の外側と内側は、異なるタンパク質や小分子と相互作用することが知られていますが、円筒の内側からチューブリン二量体の分子配置や相互作用構造を調べた研究は限られていました。そこでサブナノメートル分解能を有する液中FM-AFMを用いて、微小管の内側と外側の両方の表面におけるチューブリン二量体の分子内配列などを計測しました。その結果、微小管内側の表面構造は、外側に比べてα-、β-チューブリンヘテロ二量体を反映した大きな凹凸が可視化されました(図1)。
さらに円筒形が開いたシート状分子集合体では、1本のプロトフィラメントが隣接するプロトフィラメントよりも高くなっていました。この高さの違いは、隣接するプロトフィラメント間のα-、β-チューブリンヘテロ二量体の配向性と立体配座の相違によって生じていると考えられます。つまり円筒形からシート状への構造転移中にプロトフィラメントが再配向することが明らかになりました。内側表面における微小管の「継ぎ目」(seam line)も可視化され、これが微小管に柔軟性を与えていると考えられます(図2)。
また液中 FM-AFM計測により、局所領域でチューブリン分子が欠落した構造欠陥が存在することが明らかになりました。これらの構造欠陥の存在は、微小管の機能に大きく関係する可能性があります。さらに本研究では、微小管とタキソールの相互作用構造が可視化できるかを検討しました。タキソールは、微小管内側のβ-チューブリンにのみ結合する化学療法薬です。タキソールで安定化された微小管は、がん細胞の分裂と移動を阻害し、がんの進行を遅らせることが知られています。液中FM-AFMによって、タキソールの結合による微小管の構造変化を可視化でき、個々のα-およびβ-チューブリンサブユニットを区別することができました。さらに、得られた結果から、液中FM-AFMが微小管を標的とする薬剤の分子メカニズムを調べる分析手法として利用できる可能性が示されました。
今後の展開
液中FM-AFMによって微小管の構造、ダイナミクス、薬物相互作用に関する重要な情報が得られ、新薬発見に貢献できる可能性を示しました。また、微小管の機能とタンパク質や小分子との相互作用を理解することで、特に微小管が重要な治療ターゲットであるがんに対して、より特異的で効率的な治療法の開発につながることが期待されます。
用語解説
掲載論文情報
- 論文タイトル
- Visualizing the Submolecular Organization of αβ-Tubulin Subunits on the Microtubule Inner Surface Using Atomic Force Microscopy (原子間力顕微鏡を用いた微小管内部表面におけるα-、β-チューブリンサブユニットのサブ分子構造体の可視化)
- 著者
- Ayhan Yurtsever,Hitoshi Asakawa,Yukitoshi Katagiri,Kazufumi Takao,Koji Ikegami,Masaru Tsukada,Mitsutoshi Setou,Takeshi Fukuma(アイハン・ユルトセベル、淺川雅、片桐由智、高尾一史、池上浩司、塚田捷、瀬藤光利、福間剛士)
- 掲載誌
- Nano Letters
- 掲載日
- 2024.11.21
- DOI
- 10.1021/acs.nanolett.4c04294
- URL
- https://doi.org/10.1021/acs.nanolett.4c04294