がん生物学:幹細胞特性とがん進展を制御する分子メカニズムの可視化
造血幹細胞の機能維持と白血病発症の抑制に関わる代謝制御の重要性が明らかに

平尾 敦、金沢大学ナノ生命科学研究所 教授・主任研究者
血液細胞(赤血球・白血球・血小板)には寿命がある。そのため、健康な人の血液細胞は、骨髄中に存在するわずかな造血幹細胞が、自己複製と血液細胞への分化を繰り返すことで、枯渇することなく作られ続ける。この造血幹細胞の自己複製機能は健康な組織にとって極めて重要で、それが破綻すると骨髄不全や白血病など、様々な病気を引き起こしてしまう。
「私たちの研究によれば、代謝制御は幹細胞特性(ステムネス)を維持するのに極めて重要な役割を果たしています。代謝制御が破綻すると、白血病などの造血器悪性腫瘍の進行につながります」と平尾敦教授は説明する。「代謝制御の分子機構をより深く理解することは、白血病幹細胞を標的とした治療法を開発するうえで重要だということが分かってきました」。
平尾教授と田所優子助教は、腸内細菌叢が幹細胞のダイナミクスに影響を与えており、白血病の場合、食べ物とがんを取り巻く微小環境が、がん進展の重要な要因であることを発見した [1]。
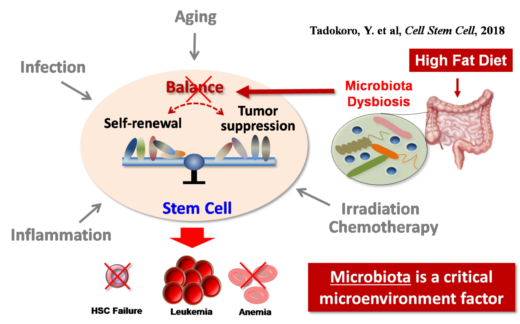
図1 造血幹細胞はそれを取り巻く微小環境によって制御される
平尾教授のグループは、以下のプロジェクトをナノ生命科学研究所で行うことを計画している。
まず、幹細胞の細胞内微細構造が、分化の際にどのように変化するかを明らかにするため、幹細胞のナノスケール解析を行う。この研究は、先進的なナノスケールイメージング技術を開発した理化学研究所の研究者らと一緒に行っている。「私たちはディープラーニングを用いた造血幹細胞画像データ認識による、ラベルフリーの全骨髄細胞解析技術を開発しています。高脂肪食のような栄養負荷による骨髄の微小環境における変化と、それに伴う造血幹細胞異常を分析したいと考えています」と、平尾教授は説明する。
もう一つのプロジェクトは、がんに関連した代謝物質の特性解析だ。現在のところ、代謝物質のリアルタイムイメージングは技術的に不可能である。「私たちは、NanoLSIの生越友樹教授(超分子化学)と共に、大環状化合物を使ってバイオマーカーを検出するケミカルセンサーの開発に取り組んでいます。がんの悪性化を促進し、がん治療の標的となる代謝酵素は、上野将也助教が作ったCRISPRカスタムライブラリーを使って特定します。主な課題は、高い特異性を持つセンサーを開発することでしょう。この異分野融合研究は、がん生物学において多くの大発見につながると思います」と、平尾教授は期待を込めて語る。
研究ハイライト
2018年に、平尾教授らは、Spred1分子が、造血幹細胞の自己複製に影響を与えることを発表した [1]。マウス実験において、通常の条件下では、Spred1は幹細胞の機能を抑制するが、食事(高脂肪食)によって引き起こされるストレス下では、造血幹細胞の恒常性を維持することを示した。この研究は、Spred1と造血との複雑な関係、およびタンパク質の機能と食事によるストレスとの関連性を示唆している。
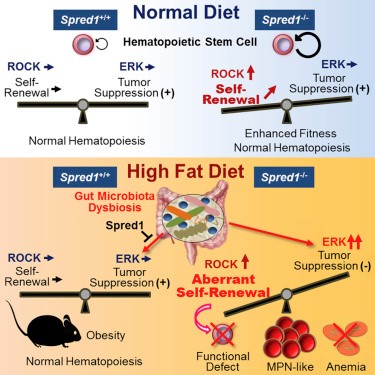
図2 参照1の研究結果
参考文献
- Yuko Tadokoro etal, “Spred1 Safeguards Hematopoietic Homeostasis against Diet-Induced Systemic Stress”, Cell Stem Cell, 22, 713–725, (2018). DOI: 10.1016/j.stem.2018.04.002

