遺伝子改変マウスモデルの開発―がん予防・治療のためのノックアウト・イノベーション
がん化と悪性化進展機構をナノスケールで可視化する

大島正伸、金沢大学ナノ生命科学研究所 教授・主任研究者
大島正伸教授は、がん生物学研究への貢献により世界的に高く評価されている。「私の研究室では、大腸がんおよび胃がんの研究を目的として、遺伝子改変マウスモデルの開発に取り組んできました。私たちが開発したモデルは、いくつもの重要な発見につながっています」。
大島教授は、1995年に、大腸がんの原因を解明するため、マウスの胚性幹細胞を使ったノックアウトマウスを作製した[1]。1996年には、COX-2を阻害することで腸管ポリープ発生が抑制されること、つまり、COX-2が大腸がん予防のターゲットであることを『Cell』に発表した [2]。「『Cell』で発表した、大腸ポリープおよび大腸がんの新しい化学予防薬(COX-2阻害薬)に関する報告は、2,000回以上も引用されました。この成果は、その後のがん治療への新しい道を開きました。いまでは、米国でも、抗炎症薬アスピリンががんを予防するという報告がなされています。ようやくここまで来た、という思いです」と、大島教授は語る。

図1 参照1の研究で使われたノックアウトマウス
近年、大島教授らは、胃がんの発生も炎症と関係があることを報告し、発がん性のWntシグナルと炎症性のCOX-2経路を活性化することによって、胃がんの発生過程をモデル化したGanマウスを開発した [3]。大島教授によると、「これはヒトのがんを再現する初の胃がんモデルです」。
「ナノ生命科学研究所のプロジェクトでは、〈がん化〉と〈悪性化進展〉メカニズムの本質をナノレベルで研究し、新たながんの診断法と治療法を開発したいと考えています。高速原子間力顕微鏡(高速AFM)と走査型イオン伝導顕微鏡(SICM)を使って、腫瘍細胞の変形や悪性化進展と、薬物動態のダイナミックな変化による細胞構造の異常を可視化するとともに、ナノ生命科学研究所でナノ計測学の研究者たちが開発中の新しいナノプローブを用いた代謝測定を行おうと考えています」と、大島教授は語る。
具体的には、細胞の表面構造や細胞骨格をナノスケールで観察し、上皮間葉転換のような悪性化進展の過程でそれらがどのように変化するかを可視化する計画だ。これは、がん細胞の進展メカニズムを理解するために重要な役割を果たすものと期待されている。
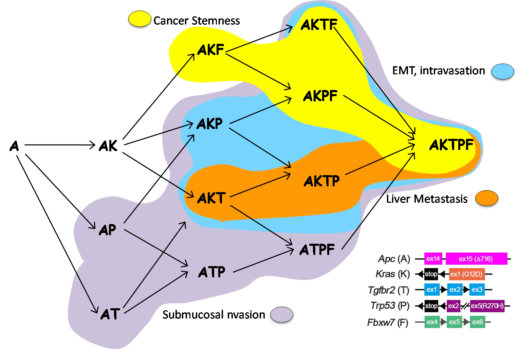
大島教授らは、さらに大腸がん悪性化の仕組みを解明するため、大腸がんのさまざまな遺伝子変異と表現型を解析した。大島教授は、「私たちが作製したA, AK, AKT, AKP, AKTPなどの大腸がん細胞コレクションは、他に類を見ないもので、未確認の変異を多数含んでいる市販のがん細胞とは大きく異なります」と強調し、「現在、上皮間葉転換という悪性化の現象は、走査型や透過型電子顕微鏡などによる静止画像に基づいて理解されています。私たちは、がん研究のためにリアルタイムで動態を可視化できるようにしたいと考えています」と意気込む。この研究は、金沢大学で、良性から悪性までのがん組織から樹立したオルガノイド細胞(A/AK/AKP/AKPT)を用いて行われている。
もう一つの研究テーマは、変異型p53のテトラマー複合形成に関するものだ。大島教授らは最近、変異型p53はホモ接合体では核に蓄積するが、野生型p53とのヘテロ接合では核に蓄積しないということを発見した [Nakayama, et al, Oncogene, 2018]。変異型p53の局在性がどのように制御されているか、またその制御が複合体形成と関係があるかについては、がんの悪性化を理解するために重要な情報となるが、まだ明らかになっていない。
研究ハイライト
2018年に大島教授らは多重遺伝子変異マウス(A, K, T, P, Fの組み合わせ)の作製に関する研究成果を発表し、遺伝子変異とがんの表現型の関係を明らかにした。これらのマウスモデルや腫瘍由来のオルガノイドの移植モデルは、大腸がんの悪性化進展プロセスを再現している。これらの結果は、特定の遺伝子変異に依存したシグナル経路を標的とすることで大腸がん転移を予防できる可能性を示す重要な成果である[Nakayama, et al, Oncogene, 2017; Sakai, et al, Cancer Res, 2018]。
参考文献
- Oshima et al. “Loss of Apc heterozygosity and abnormal tissue building in nascent intestinal polyps in mice carrying a truncated Apc gene”, PNAS, 92, 4482-4486 (1995).
DOI: 10.1073/pnas.92.10.4482 - Oshima et al. “Suppression of intestinal polyposis in Apc delta716 knockout mice by inhibition of cyclooxygenase 2 (COX-2)”, Cell, 87, 803-809, (1996).
- H Oshima et al. “Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway”, Gastroenterology, 131, 1086-1095, (2006).
- Sakai, et al. “Combined Mutation of Apc, Kras, and Tgfbr2 Effectively Drives Metastasis of Intestinal Cancer”, Cancer Res, March 2018.
DOI: 10.1158/0008-5472.CAN-17-3303

オルガノイドを用いた腫瘍の再構築
図2 大腸がん悪性化進展の過程[参照1](左)およびAKTP(緑)とAP(赤)腫瘍細胞によって再構築された大腸がん組織の多様性(右)

