肝細胞増殖因子とMET受容体を介した組織再生・がん進展の基礎研究と創薬

松本邦夫、金沢大学ナノ生命科学研究所 教授・主任研究者
松本邦夫教授は、生化学者として、がんの進展や再生医療、診断・治療の創薬に関する基礎研究に打ち込んできた。「金沢大学での学士課程と修士課程、大阪大学での博士課程では植物の光合成の研究をしました。医療現場で研究に携わることはなかったです」と松本教授は語る。「その後、大阪大学付属病院の皮膚科に勤務することになりました。医者ではないので患者さんを診ることはなかったけど、研究のために患者さんのサンプルを見ることはありました。医師免許を持たずに病院で働くことに、友人たちからは将来はないよと言われました」。
「今振り返れば、病院で働く機会を得て、医療の現場で医師が患者に向き合い、治療する様子を直に見たことは、貴重な経験でした。今でも忘れられないのは、悪性腫瘍で額に大きな穴が開いてしまった男の子の健気な様子です」。「基礎研究者が、臨床部門で働くのは極めて稀です。思えば、意図せず異分野に身を置いたんですね。一歩踏み出す経験ができました。それ以上に、病気の人の助けになる研究をしたい。そう決意できました。この時の経験が、その後の私の研究、増殖因子と創薬に関わる研究につながっています」。
増殖因子は、細胞膜にある受容体を活性化することで細胞増殖を促すシグナルを送るタンパク質である。増殖因子をカギとすれば受容体はカギ穴に相当する。松本教授は、肝細胞増殖因子(HGF: Hepatocyte Growth Factor)と MET 受容体に着目し、組織の再生・修復やがんにおけるHGFの機能を中心に研究している(図1)。
松本教授らの研究は、HGFの役割について、組織の再生・修復という、いわば好ましい面と、がんの転移・薬剤耐性という好ましくない面、両面に光を当てている(図2)。「1991年 [1]、私たちは、HGFが腎臓の発生や再生、つまり組織の再構築に必要な管腔形成(器官形成における上皮組織の管状組織の形成のこと)を誘導することを発表しました」と松本教授は説明する。「HGFは管腔形成を誘導した唯一の増殖因子でした。その後、HGFがニューロンの生存を促進することを発見しました。またHGFは、腎臓病や筋萎縮性側索硬化症(ALS)、脊髄損傷などの疾患モデルにおいて治療効果を示しました」。「HGFが大きな可能性を秘めていることに気づいたのです。腎臓病やALS、脊髄損傷の治療に役立つのではないか、と」。
これらの有望な基礎研究の成果に基づいて、松本教授らは創薬ベンチャーとしてクリングルファーマ株式会社 [2] を起業した。2019年には、脊髄損傷の患者を対象に組換えHGFタンパク質による第Ⅰ/Ⅱ相臨床試験が終了し、 安全性や有効性を示唆する結果が得られた。現在、難病として知られるALSに対する第II相臨床試験が進められている。松本教授は「基礎研究に携わる者として、患者さんのためになる仕事をしたい」と熱意を込めて語る。また、ここ数年は、ケミカルバイオテクノロジーや高速原子間力顕微鏡(高速AFM)を用いたナノ分子動態計測など、異分野との連携・融合に積極的に取り組み、研究を拡大している。ケミカルバイオテクノロジーとの連携では、環状ペプチドを使って、HGFと同様にMET受容体を活性化できる人工合成HGFの発見に成功した(図1、右側)[3]。また、最近では、HGFに結合し、HGFを阻害する環状ペプチドとして、HiP-8(HGF-inhibitory Peptide-8)が見出された[4]。HiP-8はがんの診断や治療に応用されることが期待される。
現在、ナノ生命科学研究所で行っている主要な研究は、受容体活性化の動態と構造の解明、および、環状ペプチドを用いた再生医療とがんの診断・治療のための創薬だ。松本教授はナノ生命科学研究所の走査型プローブ顕微鏡を専門とする研究者たちと協同する中で、MET活性の構造動態の直接観察に初めて成功した。
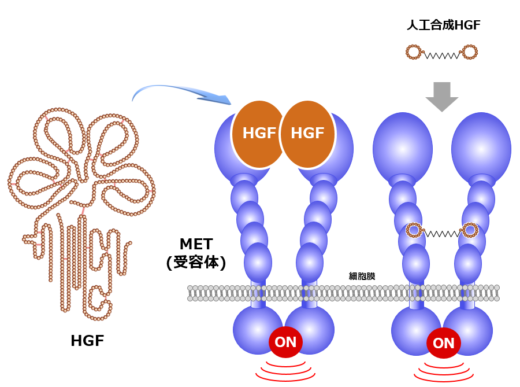
図1 HGF、MET受容体、人工HGFの構造
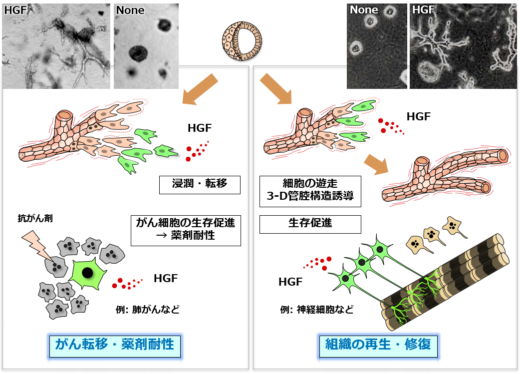
図2 組織再生ならびにがん転移におけるHGFの役割
研究ハイライト
HGFにドッキングすることでHGFを阻害する環状ペプチド(HGF-inhibitory Peptide-8: HiP-8)を発見した。NanoLSIの柴田准教授と連携し、HiP-8とHGFとの相互作用を高速AFMで解析した結果、HiP-8はHGFのダイナミックな動きを阻害することが分かった[4]。小さな分子がタンパク質の分子動態を止めることを示した初めての例である。また、同共同研究チームにより、MET受容体活性化の新たなメカニズムが見出されつつある(未発表)。
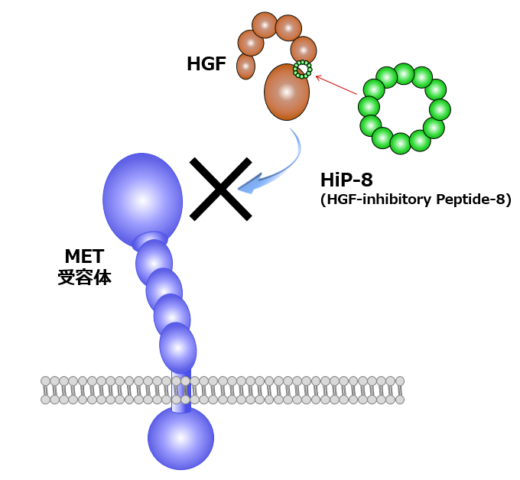
図3 HiP-8の働き
参考文献
- R. Montesano, K. Matsumoto, T, Nakamura, L. Orci, “Identification of a fibroblast-derived epithelial morphogen as hepatocyte growth factor”, Cell 67, 901-8, (1991). doi.org/10.1016/0092-8674(91)90363-4
- Kringle Pharm, Inc. http://www.kringle-pharma.com/
- K. Ito et al, “Artificial human Met agonists based on macrocycle scaffolds”, Nature Commun, 6 6373, (2015).
- K. Sakai, T. Passioura, H. Sato, K. Ito, H. Furuhashi, M. Umitsu, J. Takagi, Y. Kato, H. Mukai, S. Warashina, M. Zouda, Y. Watanabe, S. Yano, M. Shibata, H. Suga & K. Matsumoto, “Macrocyclic peptide-based inhibition and imaging of hepatocyte growth factor”, Nature Chemical Biology, 15, 598–606 (2019)

