免疫寛容に関わる細胞の特定に世界に先駆けて成功!
- リンパ節内で,遺伝性自己免疫疾患(※1)であるAPECED(※2)の原因遺伝子であるAire(※3)を発現する細胞を同定することに成功した。
- この細胞が,自然リンパ球(※7)の一種と類似した特徴を持ち,リンパ節において免疫寛容(※8)の一部を担っていることを発見した。
- 将来,原因が不明である膠原(こうげん)病や自己免疫疾患に対する原因解明およびその治療法の確立につながることが期待される。
概要
金沢大学医薬保健研究域医学系/ナノ生命科学研究所の山野友義助教,華山力成教授,ミュンヘン大学(ドイツ)のLudger Klein(ルートガー・クライン)教授,分子遺伝学研究所(チェコ)のDominik Filipp(ドミニク・フィリップ)教授らの国際共同研究グループは,リンパ節内で,遺伝性自己免疫疾患(※1)であるAPECED(※2)の原因遺伝子であるAire(※3)を発現する細胞を同定することに成功しました。
未熟なT細胞(※4)が分化をする場である胸腺では,自身を攻撃する可能性があるT細胞は除去されます。Aireはこの過程において重要な役割があり, Aireがうまく働かないと自身を攻撃するT細胞が胸腺内で除去されず,自己免疫疾患を発症します。これまでAireは胸腺のみで発現すると考えられてきていましたが,最近の研究から成熟したT細胞が集まるリンパ節においてもAireを発現する細胞が存在することが示されました。しかし,どの細胞がAireを発現しているのか,どのような役割があるかについては,複数のグループが異なった主張をしており,結論が出ていませんでした。
今回,本研究グループは,2種類のAire レポーターマウス(※5)と高感度のAire抗体を用いたフローサイトメトリ―(※6)の解析により,リンパ節に存在する細胞のおよそ0.01%のごくわずかな細胞にAireが発現していることを発見しました。さらに,この細胞は自然リンパ球(※7)の一種と類似した特徴を持ち,リンパ節において自己を攻撃するT細胞を除去する役割があることが分かりました。
本研究成果は,リンパ節でAireを発現する細胞は何であるのかという議論に終止符を打つものであり,免疫寛容(※8)の一部を担う新たな細胞を発見したものです。このような知見の積み重ねによって,将来,原因が不明である膠原(こうげん)病や自己免疫疾患に対する原因解明およびその治療法の確立につながることが期待されます。
本研究成果は,2019年3月27日午前9時(米国東海岸標準時間)に米国科学誌「Journal of Experimental Medicine」のオンライン版に掲載されました。
研究の背景
胸腺はT細胞が分化する場であり,T細胞はさまざまな病原菌やウイルスに対応するために,T細胞ごとに多様なT細胞受容体を形成します。しかし,多様なT細胞受容体の中には自己に対して反応する受容体を持ったT細胞(自己反応性T細胞)が存在しており,自己反応性T細胞は胸腺内で除去される必要があります。胸腺内で自己反応性T細胞が除去される仕組みを中枢性免疫寛容といいます。胸腺に存在する胸腺髄質上皮細胞は中枢性免疫寛容において中心的な役割を果たします。胸腺髄質上皮細胞は膵臓β細胞が出すインスリン(※9)や肝臓のC反応性タンパク質(※10)といった本来特定の臓器でしか発現しないタンパク質(組織特異的抗原)を発現し,それを自己反応性T細胞に提示することによって,自己反応性T細胞を除去します(図1)。この胸腺髄質上皮細胞において組織特異的抗原の発現の一部を制御する遺伝子がAireです。Aireの変異は胸腺における組織特異的抗原の発現低下につながり,自己反応性T細胞が胸腺内で除去されなくなるため,多臓器における自己免疫疾患が発症すると考えられています。この免疫寛容に必須のAireは胸腺にのみ発現がみられると考えられてきましたが,免疫反応が起こる場である末梢のリンパ節内で発現する細胞がいることを複数の研究グループが発表しました。しかし,それぞれの研究グループの主張が異なっており,結論は出ていませんでした。
研究成果の概要
これまで,本研究グループは胸腺における中枢系免疫寛容の誘導のメカニズムを解析してきました。その過程において,胸腺に限って発現すると考えられていたAire遺伝子がリンパ節に発現することを発見しました。そこで,リンパ節内でAire遺伝子を発現する細胞を2種類のAire レポーターマウスと高感度のAire抗体を用いたフローサイトメトリ―の解析によって詳しく調べた結果,リンパ節にある細胞のおよそ0.01%と非常に少ない分画にAireを発現する細胞の存在を確認しました。Aireを発現する細胞は,免疫反応に必要な細胞膜表面にある糖タンパク質「主要組織適合遺伝子複合体(MHC)」のうち,抗原提示細胞など限られた細胞にのみ発現しているMHCIIの発現や,T細胞が抗原を認識し,十分に活性化する際に必要となる補助シグナル分子の発現が高く,抗原提示細胞としての役割があることが分かりました。そこで,この細胞の形態,細胞表面分子,遺伝子発現プロファイルを調べたところ,腸管において恒常性維持や炎症反応に重要な役割を持つ自然免疫細胞の一種である3型自然リンパ球(ILC3)とよく似た特徴を持っていることが分かりました。本研究グループはこの細胞を「Aire-ILC3 like細胞」と名付けました。先行研究グループの主張する細胞分画ではAireのmRNA(※11)は検出できたものの,Aireタンパク質の発現が見られた細胞分画はAire-ILC3 like細胞だけでした。
次に,野生型マウスとAire遺伝子を欠くAireノックアウトマウスにおいてAire-ILC3 like細胞の遺伝子発現プロファイルを比較したところ,およそ700個の遺伝子がAireによって制御されていることが分かりました。また,インフルエンザウイルスのへマグリチニン抗原(HA抗原)をAireが発現する細胞に発現させたマウスを用いた実験において,Aire-ILC3 like細胞はHA反応性T細胞をリンパ節内で除去することが判明しました(図3)。これらの結果より,Aire-ILC3 like細胞はリンパ節において免疫寛容の一部を担う細胞であることが明らかになりました。
今後の展開
免疫寛容の破綻は自己免疫疾患発症へとつながります。リンパ節内での末梢性T細胞免疫寛容は制御性T細胞による抑制,自己反応性T細胞の除去およびアナジー(※12)誘導によって成り立っていると考えられていますが,自己反応性T細胞の除去およびアナジー誘導に関してはどの細胞がどのように関わっているのか分かっていません。本研究で発見したAire-ILC3 like細胞は,一部の自己反応性T細胞の除去に関わると考えられます。今後,Aire-ILC3 like細胞および他の免疫寛容を誘導する細胞がどのようなメカニズムで免疫寛容を維持しているのかを一つ一つ明らかにしていくことにより,原因が不明である膠原病や自己免疫疾患の原因解明およびその治療法の確立へとつながることが期待されます。
本研究は,日本学術振興会卓越研究員事業の支援を受けて実施されました。
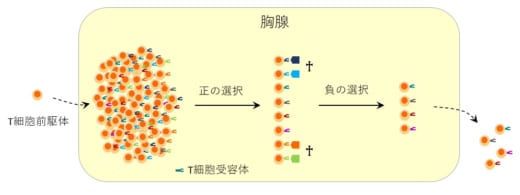
図1. 自己に対して攻撃するT細胞は胸腺で除去される
T細胞前駆体は胸腺で分化・成熟する。T細胞ごとに多様なT細胞受容体を形成するが,その中には自己反応性T細胞が含まれる。自己反応性T細胞は胸腺内で負の選択を受け除去され,自身に対して寛容なT細胞が分化を終え,リンパ節や脾臓といった末梢リンパ組織へと移行する。
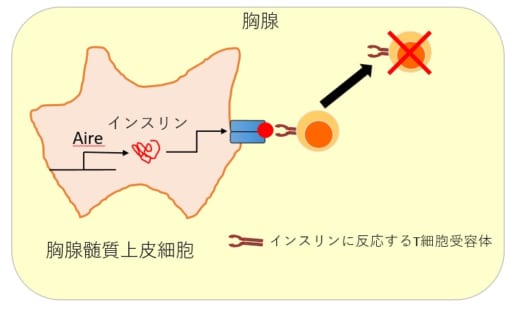
図2. Aireは胸腺髄質上皮細胞の組織特異的抗原を誘導し,自己反応性T細胞除去に貢献する
胸腺髄質上皮細胞は本来特定の臓器でしか発現しないタンパク質(例 インスリン,C反応性タンパク質など)を発現する。それによって,インスリンに反応する自己反応性T細胞を胸腺内で除去することができる。
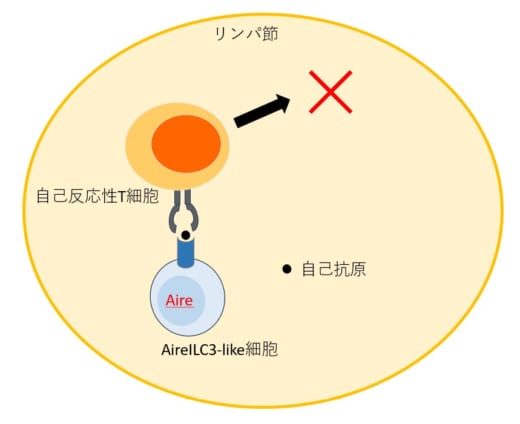
図3. AireILC3-like細胞はリンパ節内で自己反応性T細胞を除去する
リンパ節内でAireILC3-like細胞は自己抗原を提示することで,自己反応性T細胞を除去することが明らかになった。
用語解説
掲載論文情報
- 論文タイトル
- Aire expressing ILC3-like cells in the lymph node display potent APC features
(リンパ節内でAireを発現する新規細胞の同定) - 著者
- Tomoyoshi Yamano, Jan Dobeš, Matouš Vobořil, Madlen Steinert, Tomas Brabec, Natalia Zietara, Martina Dobesova, Caspar Ohnmacht, Martti Laan, Pärt Peterson, Vladimir Benes, Radislav Sedlacek, Rikinari Hanayama, Michael Kolar, Ludger Klein, and Dominik Filipp
(山野友義,ヤン・ドベシュ,マトウ・ボボリ,マドレン・スタイナート,トマス・ブラベック,ナタリア・ジエトラ,マルティナ・ドベソワ,カスパー・オンマハト,マルティ・ラーン,パート・ペーターソン,ウラジミール・べネス,ラディスラヴ・セドレツク,華山力成,ミハエル・コーラー,ルートガー・クライン,ドミニク・フィリップ) - 掲載誌
- Journal of Experimental Medicine
- 掲載日
- 2019.03.27
- DOI
- 10.1084/jem.20181430
- URL
- http://jem.rupress.org/content/early/2019/03/26/jem.20181430

