胃がん発生を促進するmicroRNAの特定に成功!
- 胃がんの発生を促進するmicroRNA(※1)の特定に成功した。
- サイトカイン分子(※3)の一つであるインターロイキン1(IL-1)の刺激により,胃粘膜上皮細胞でmiR-135bというmicroRNAの発現が誘導することを発見した。
- miR-135bは,胃がん細胞の増殖抑制に作用するFOXN3やRECKなどの標的遺伝子の発現を抑制することで,胃粘膜上皮細胞の増殖を亢進し,胃がん細胞の浸潤などの悪性化にも関与すると考えられる。
- 将来,miR-135bの検出による胃がんの早期診断や,miR-135bを標的とした新規予防・治療法の開発に活用されることが期待される。
概要
金沢大学ナノ生命科学研究所/がん進展制御研究所の大島正伸教授の研究グループは,胃がんの発生を促進するmicroRNA(※1)の特定に成功しました。
日本人で罹患率の高い胃がんには,ヘリコバクター・ピロリ菌(※2)感染が関わっていることが知られていますが,感染がどのように胃がんの発生を促進するのかは,よく分かっていません。本研究グループでは,ヘリコバクター・ピロリ菌感染により引き起こされる慢性炎症反応による発がん促進機構に着目した研究を推進しました。その結果,サイトカイン分子(※3)の一つであるインターロイキン1(IL-1)の刺激により,胃粘膜上皮細胞でmiR-135bというmicroRNA(短鎖RNA)の発現が誘導することを突き止めました。miR-135bは,胃がん細胞の増殖抑制に作用するFOXN3やRECKなどの標的遺伝子の発現を抑制することで,胃粘膜上皮細胞の増殖を亢進し,胃がん細胞の浸潤などの悪性化にも関与すると考えられます。
これらの知見は将来,miR-135bの検出による胃がんの早期診断や,miR-135bを標的とした新規予防・治療法の開発に活用されることが期待されます。本研究は,金沢大学,ハドソン医学研究所(オーストラリア),ソウル大学(韓国)との共同研究により行なわれました。
本研究成果は,2018年11月30日(米国東部標準時間)に米国消化器学会(AGA)学術雑誌「Gastroenterology」のWebサイト“Articles in press”に掲載されました。
研究の背景
胃がんは,日本を含むアジア地域に多いがんで,ヘリコバクター・ピロリ菌感染が関与していることが知られています。現在,ヘリコバクター・ピロリ菌の除菌が胃がんの予防に有効と考えられていますが,ヘリコバクター・ピロリ菌の感染が発がんを促進する分子機構については明らかにされていません。
一方で,microRNAと呼ばれる20から25の塩基で構成される小さなRNA分子は,さまざまな遺伝子のメッセンジャーRNAを分解することで,標的遺伝子の発現を抑制する分子群です。最近の研究では,microRNAが発がんにも関与することが明らかになってきています。
以上の研究背景から,本研究グループでは胃炎および胃がんを自然発症するマウスモデルを用いて,ヘリコバクター・ピロリ菌感染による胃がん発生過程に,microRNAが関与する可能性について研究を行いました。
研究成果の概要
金沢大学で開発された胃がんマウスモデル(Ganマウス)は,ヒトの胃がんモデルとして国際的にも広く研究に使用されています。本研究グループでは,レーザーマイクロダイセクション装置(※4)を使って,Ganマウスの胃がん組織から,腫瘍細胞とそれ以外の間質細胞(※5)を分離して採取し,腫瘍細胞だけで発現が変化するmicroRNAをマイクロアレイによって探索し,候補分子を明らかにしました。その中から,ヒト胃がん組織で最も顕著に発現が亢進しているmicroRNAとして,miR-135bを特定しました。
さらに,miR-135bの発現は,ヘリコバクター・ピロリ菌の類縁種であるヘリコバクター・フェリス菌を感染させたマウス胃炎組織でも強く誘導されることが確認されました。その分子機構として,感染が引き起こす胃炎組織では,活性化した間質細胞がサイトカイン分子のインターロイキン1(IL-1)を産生し,それが胃粘膜上皮細胞を直接刺激してmiR-135bの産生を誘導することを明らかにしました。また,miR-135bを強く発現する胃がん細胞が,miR-135bを細胞外に分泌する現象も認めました。
感染により胃炎を起こすと,胃粘膜上皮細胞の増殖が亢進して粘膜が肥厚しますが,重要なことに,慢性胃炎を起こしたマウスモデルにおいて,miR-135b遺伝子を欠損させると,胃粘膜上皮細胞の増殖が顕著に抑制されて粘膜の肥厚が抑えられることを明らかにしました。すなわち,炎症反応で発現誘導するmiR-135bは,胃がん細胞だけでなく,前がん状態の胃粘膜上皮細胞の増殖を促進する作用により,胃がんの発生を促進すると考えられます。miR-135bが標的として発現を制御する遺伝子を探索した結果,FOXN3とRECKが重要な候補であることが分かりました。これらの遺伝子の発現抑制がどのように発がんに関与するかを解明することは,今後の課題になります。
以上の結果から,miR-135bは胃がんの早期発見マーカーとなる可能性とともに,胃がんの予防・治療標的分子となる可能性が期待されます。
今後の展開
本研究により,ヘリコバクター・ピロリ菌感染が引き起こす慢性炎症反応が,miR-135bを誘導して胃がん発生を促進することが明らかになりました。今後の研究により,miR-135bを直接標的とした胃がんの診断,および予防治療法の開発を目指した研究が展開されます。さらに,miR-135bが標的とするFOXN3やRECKに関する研究が進展することにより,胃がんの詳細な発生・悪性化機構の解明につながることが期待されます。
本研究は,国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究開発領域における研究開発課題「消化器がんの発生・進展過程における慢性炎症の誘導と役割の解明」(研究開発代表者:大島正伸)の一環で行われました。なお,本研究開発領域は,平成27年4月の日本医療研究開発機構の発足に伴い,国立研究開発法人科学技術振興機構(JST)より移管されたものです。
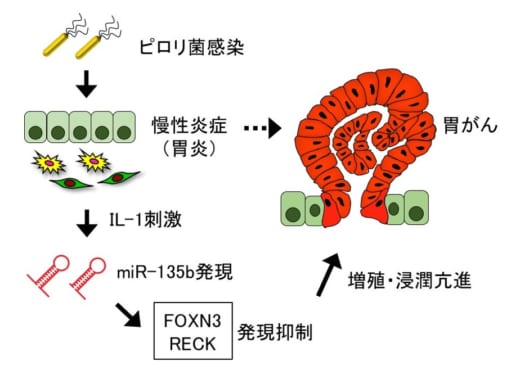
図:miR-135bを介した胃がん発生のメカニズム
ヘリコバクター・ピロリ菌に感染した胃粘膜では慢性的に炎症が起きている。胃炎組織の間質細胞はIL-1を産生して胃粘膜上皮細胞を刺激し,miR-135bの発現を誘導する。miR-135bはFOXN3やRECKの発現を抑制して,胃がん細胞の増殖や浸潤が亢進すると考えられる。
用語解説
掲載論文情報
- 論文タイトル
- Interleukin 1 upregulates microRNA-135b to promote inflammation- associated gastric carcinogenesis in mice
(インターロイキン1はmicroRNA-135bの発現を誘導して炎症依存的な胃がん発生を促進する) - 著者
- Han TS, Voon DC, Oshima H, Nakayama M, Echizen K, Sakai E, Yong ZWE, M, Murakami K, Yu L, Minamoto T, Ock CY, Jenkins BJ, Kim SJ, Yang HK, and Oshima M.
(テス ハン,ドミニク ブーン,大島浩子,中山瑞穂,越前佳奈恵,坂井絵梨,ザッカリー ヨン,村上和弘,リアン ユー,源利成,チャンヨン オク,ブレンダン ジェンキンス,ソンジン キム,ハンガン ヤン,大島正伸) - 掲載誌
- Gastroenterology
- 掲載日
- 2018.11.30
- DOI
- 10.1053/j.gastro.2018.11.059
※preview versionのため,最終修正が加わる可能性があります。 - URL
- https://doi.org/10.1053/j.gastro.2018.11.059