カビが植物の硬い壁を突き破る力の正体を解明-糸状菌の新規ポリマーが生物界屈指の膨圧を制御-
理化学研究所(理研)環境資源科学研究センター植物免疫研究グループの熊倉直祐上級研究員、白須賢グループディレクター、金沢大学理工研究域フロンティア工学系/ナノ生命科学研究所(WPI-NanoLSI)の宮澤佳甫助教らの国際共同研究グループは、植物病原菌(糸状菌)における膨圧[1]発生に必要な新規遺伝子ペアを発見し、これが新規ポリマーの生合成を通じて感染に必要な膨圧を制御することを明らかにしました。
本研究成果は、細胞における膨圧発生メカニズムの理解を深めるとともに、病原性のみを抑制する低環境負荷型農薬の開発に貢献することが期待されます。
今回、国際共同研究グループは、植物病原糸状菌(カビ)が宿主植物に侵入する際に形成する感染用の細胞「アプレッソリア(付着器)[2]」に着目しました。アプレッソリアは、車のタイヤの空気圧の約40倍にも及ぶ生物界屈指の高い膨圧を生み出し、その力で硬い植物表面を突き破り、感染を可能にします。
国際共同研究グループは、アプレッソリア形成時に遺伝子発現が上昇する機能未知の遺伝子を、独自に開発したゲノム編集技術で破壊し、病原性に寄与する遺伝子のスクリーニングを行いました。その結果、膨圧形成に必須な二次代謝物生合成酵素[3]ペアであるPKS2およびPBG13を同定しました。さらに、PKS2およびPBG13はジヒドロキシヘキサン酸(dihydroxyhexanoic acid:DHHA)[4]をモノマー(単量体)単位とするポリマー(重合体)を生合成することで、アプレッソリアの膨圧形成に寄与することを明らかにしました。
本研究は、科学雑誌『Science』オンライン版(2月12日付:日本時間2月13日)に掲載されました。
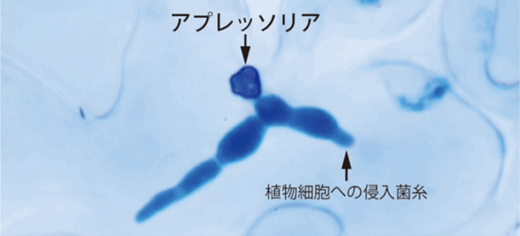
高い膨圧により植物細胞に菌糸を侵入させる植物病原糸状菌のアプレッソリア
背景
アプレッソリアは、炭疽病菌(たんそびょうきん)[5]やイネいもち病菌[5]などの植物病原糸状菌が形成する感染に重要な細胞です。これらの世界の作物に甚大な被害をもたらす糸状菌は、宿主植物表面にアプレッソリアを形成します。アプレッソリアは、生物界屈指の約8メガパスカル(MPa、1MPaは100万パスカル:8MPaは車のタイヤの空気圧の約40倍)に及ぶ高い膨圧を発生させます。
植物細胞の成長や気孔の開閉に使われる膨圧が通常0.3~1MPaであることと比較しても、アプレッソリアの膨圧が高いことが分かります。この膨圧によって、アプレッソリア底部に形成された針状の貫穿糸(かんせんし)[6]が強く押し出され、硬い植物組織の表面を物理的に突き破ることで、感染が成立します。
アプレッソリアは植物表面に付着した胞子から分化し、内部にグリセロールなどの浸透圧調整物質[1]を高濃度に蓄積します。これにより生じた浸透圧[1]によって周囲の水を吸収して高い膨圧を生成します。すなわち、アプレッソリアの細胞壁は、小さな水分子を通す一方で、分子量の大きい浸透圧調整物質は遮断する半透膜[1]として機能します。
これまで、アプレッソリアに特徴的な黒色の色素であるメラニン[7]が細胞壁の半透性に寄与すると考えられてきました。しかしながら近年ではメラニン欠損変異体でも膨圧を形成する例が報告され、未知の因子の存在が示唆されていました。
研究手法と成果
国際共同研究グループはまず、炭疽病菌のアプレッソリア形成時に遺伝子発現が上昇する機能未知の遺伝子を、CRISPR-Cas9を用いたゲノム編集技術[8]によって破壊し、病原性が低下する変異体を探索しました。その結果、感染に必須な二次代謝物生合成酵素をコードするペア遺伝子PKS2およびPBG13を同定しました(図1A)。これらの遺伝子はイネいもち病菌にも機能的に保存されていました。さらに、PKS2およびPBG13の破壊株では、いずれもアプレッソリアから侵入菌糸が形成されず、この遺伝子ペアがアプレッソリア機能に必須であることが明らかとなりました(図1B)。
そこで、アプレッソリアにおける膨圧を異なる手法で検証しました。浸透圧の原理を利用した手法と、原子間力顕微鏡(AFM)[9]を用いた硬さの計測[9]のいずれにおいても、PKS2とPBG13の遺伝子を破壊した変異体(以降pks2およびpbg13変異体と表記)で膨圧が低下していることが示されました(図1C)。
次に、PKS2とPBG13がどのように膨圧に寄与しているのかを検証しました。アプレッソリアにおいて半透膜として機能する細胞壁について、さまざまな分子量を持つ浸透圧調整物質の透過性を指標として孔(あな)サイズを評価しました。その結果、野生型では分子量約140以上の分子を通さず0.4~1.7ナノメートル(nm、1nmは10億分の1メートル)程度と推定されたのに対し、pks2およびpbg13変異体では分子量が10,000の分子も透過させ5nm以上と推定されました(図1D)。すなわち、PKS2およびPBG13は半透膜として機能する細胞壁の孔サイズを縮小し、分子量の大きい浸透圧調整物質が透過するのを止める役割を担っていることが示されました。
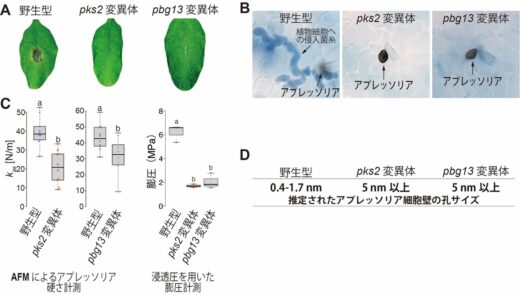
図1 アプレッソリアの細胞壁孔サイズを制御するPKS2およびPBG13の同定
A. PKS2およびPBG13は炭疽病菌の感染に必須である。野生型炭疽病菌は植物葉上で黒色の病斑(びょうはん)を形成したが、pks2およびpbg13変異体では病斑が認められなかった。
B. PKS2およびPBG13はアプレッソリアからの植物細胞侵入に必要である。野生型炭疽病菌では、アプレッソリアから植物細胞内へ伸長した侵入菌糸が観察されたが、pks2およびpbg13変異体では観察されなかった。
C. PKS2およびPBG13はアプレッソリアにおける膨圧形成に寄与する。左:原子間力顕微鏡(AFM)によるアプレッソリアの硬さの計測結果。pks2およびpbg13変異体では、野生型と比較してアプレッソリアの硬さが有意に低下した。kas (N/m)は、AFMで測定したアプレッソリア表面の硬さを表す指標であり、この値が大きいほど硬いことを示す。右:浸透圧の原理を用いた膨圧計測法においても、pks2およびpbg13変異体では、野生型に比べて膨圧が有意に低下していた。
D. PKS2およびPBG13は半透膜として機能するアプレッソリア細胞壁の孔サイズ縮小に寄与する。分子サイズの異なる溶質の透過性を指標として、細胞壁孔サイズを推定した結果、pks2およびpbg13変異体では野生型に比べて細胞壁の孔サイズが大きくなっていることが示された。
PKS2およびPBG13の遺伝子について、経時的な発現変化をリアルタイムPCR[10]で解析したところ、両遺伝子はアプレッソリアの細胞壁が形成されるタイミングで発現のピークを示しました(図2A)。さらに、PKS2とPBG13それぞれを蛍光タンパク質[11]と融合させたライブセルイメージング(生細胞イメージング)により、両タンパク質がアプレッソリアの細胞質に局在することが明らかとなりました(図2B)。これらの結果は、PKS2およびPBG13が細胞壁形成の初期段階において、何らかの二次代謝物を生合成することで、細胞壁の孔サイズ縮小に寄与することを示唆しています。
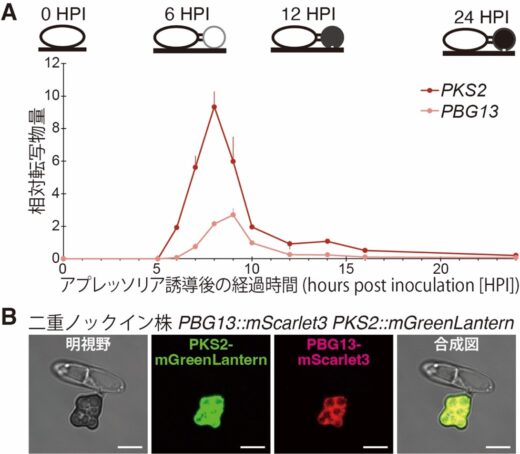
図2 アプレッソリア形成時に発現ピークを迎え、細胞質に局在するPKS2およびPBG13
A. PKS2およびPBG13転写物の経時的リアルタイムPCR解析。PKS2およびPBG13はアプレッソリア誘導後約8~9時間で発現ピークを迎えた。
B. 炭疽病菌アプレッソリアにおけるPKS2およびPBG13の局在。PKS2-mGreenLanternおよびPBG13-mScarlet3を共焦点蛍光顕微鏡で観察した結果、両タンパク質はいずれも細胞質に局在していた。本解析には、PKS2およびPBG13のコード配列の終止コドン(タンパク質合成の終了を示す塩基3個の配列)直前に、それぞれmGreenLanternとmScarlet3の蛍光タンパク質をノックイン(導入)した二重ノックイン株を用いた。
そこで、PKS2とPBG13が生合成する二次代謝物の解析を行いました。イネいもち病菌の菌糸細胞においてPKS2およびPBG13の遺伝子を発現させたところ、分子量130刻みの化合物ピークが検出され、分子量130のモノマー単位から成るポリマーが生合成されていることが示されました(図3A)。さらに、高分解能質量分析[12]およびNMR[12]解析により、このモノマーがジヒドロキシヘキサン酸(DHHA)で、それがエステル結合[13]したポリマーを生成していることが明らかとなりました(図3B)。
最後に、実際のアプレッソリアにおいてDHHAが生合成されているかを検証しました。その結果、高密度誘導が可能なアブラナ科炭疽病菌のアプレッソリアからDHHAが検出されました(図3C)。さらに、炭疽病菌のアプレッソリアから精製したPKS2とPBG13の生化学反応系からもDHHAが検出され、PKS2およびPBG13がDHHAの生合成に必要・十分であることが明らかとなりました(図3D)。
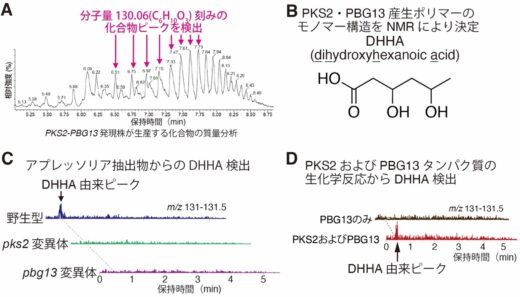
図3 PKS2およびPBG13はDHHAをモノマーとするポリマーを生合成
A. PKS2およびPBG13を菌糸で異所発現させたイネいもち病菌において、分子量130刻みの化合物 ピークが検出された。PKS2およびPBG13発現株がC6H10O3(分子量: 130)をモノマー単位とするポリマーを生合成することが示された。
B. 高分解能質量分析およびNMR解析により、PKS2およびPBG13産生ポリマーのモノマー構造を決定した。PKS2およびPBG13は、DHHAモノマーがエステル結合したポリマーを生合成することが明らかとなった。
C. 炭疽病菌アプレッソリアからDHHAを検出した。In vitro(試験管内)条件下で高密度誘導したアブラナ科炭疽病菌野生型のアプレッソリア抽出物からDHHAが検出された一方、pks2およびpbg13変異体からは検出されなかった。m/z:質量電荷比で、分子量を表す。
D. PKS2およびPBG13の生化学反応により、DHHAが生合成された。
以上の結果から、PKS2およびPBG13が生合成するDHHAポリマーは、アプレッソリア細胞壁の孔サイズを縮小させることで浸透圧調整物質の流出を防ぎ、その結果として高い浸透圧および膨圧の形成に寄与すると考えられます(図4A)。
DHHAポリマーがどのような分子機構によって細胞壁の孔サイズを縮小するかは今後の課題ですが、DHHAポリマーが細胞壁の構成要素(キチン、グルカン、メラニンなど)と相互作用することで、細胞壁の間隙を狭めている可能性が考えられます(図4B)。
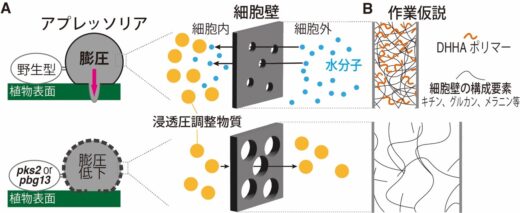
図4 PKS2、PBG13が生合成するDHHAポリマーによるアプレッソリア膨圧制御モデル
A. アプレッソリアは、PKS2およびPBG13によって生合成されるDHHAポリマーにより、細胞壁の孔サイズを縮小することで、高い膨圧を発生させる。
B. DHHAポリマーの作用モデル。キチン、グルカンなどを主な成分とするスポンジ状構造の細胞壁において、DHHAポリマーが細胞壁成分と相互作用することで狭め、半透性を高めるモデル。
今後の期待
本研究では、炭疽病菌やイネいもち病菌において、感染時に必要な高い膨圧発生を担う遺伝子ペアを発見し、その機能を明らかにしました。これにより、これまでブラックボックスであった生物界屈指の膨圧発生メカニズムの一端が、分子レベルで理解できるようになりました。
今後は、DHHAポリマーが細胞壁内でどのような分子と結合し、どのように機能しているのかを明らかにすることで、膨圧発生の全体像の解明を目指します。こうした基礎的な知見は、植物病原糸状菌が作物に侵入する仕組みを理解し、制御するための基盤となります。
炭疽病菌やイネいもち病菌は世界中の主要作物に甚大な被害を与えています。PKS2およびPBG13を標的とする阻害剤は、菌を殺すのではなく病原性のみを抑制することが期待できるため、耐性菌の出現や環境負荷を抑えた新しい病害制御技術につながります。
さらに、アプレッソリアの細胞壁は、高い膨圧に耐える物理的強度を備えた半透膜として機能します。半透膜構造の知見とDHHAポリマーは、機能性バイオマテリアルの設計や創製への応用が期待されます。
本研究成果は、国際連合が定めた17の目標「持続可能な開発目標(SDGs)[14]」のうち、「2. 飢餓をゼロに」および「15. 陸の豊かさも守ろう」に貢献するものです。
【国際共同研究グループ】
理化学研究所 環境資源科学研究センター
植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
上級研究員 熊倉 直祐(クマクラ・ナオヨシ)
専任研究員 本山 高幸(モトヤマ・タカユキ)
研究員 石濱 伸明(イシハマ・ノブアキ)
研究員(研究当時)パメラ・ガン(Pamela Gan)
研修生 米原 克磨(ヨネハラ・カツマ)
分子構造解析ユニット
ユニットリーダー 越野 広雪(コシノ・ヒロユキ)
技師 野川 俊彦(ノガワ・トシヒコ)
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
テクニカルスタッフⅡ 後藤 友美(ゴトウ・ユウミ)
金沢大学
ナノ生命科学研究所
所長/教授 福間 剛士(フクマ・タケシ)
理工研究域フロンティア工学系/ナノ生命科学研究所
助教 宮澤 佳甫(ミヤザワ・ケイスケ)
大学院自然科学研究科 フロンティア工学専攻
修士課程学生(研究当時)松森 海晴(マツモリ・カイセイ)
パリ=サクレー大学/フランス国立農業・食糧・環境研究所(INRAE)
研究ディレクター リチャード・オコネル(Richard O’Connell)
研究員 ジュリアン・ペルニエ(Julien Pernier)
顕微鏡プラットフォーム運用責任者 坂井 香織(サカイ・カオリ)
パリ=サクレー大学/フランス国立科学研究センター(CNRS)
研究ディレクター サンドリーン・レベック=フォート(Sandrine Lévêque-Fort)
用語解説
掲載論文情報
- 論文タイトル
- Dihydroxyhexanoic acid biosynthesis controls turgor in pathogenic fungi
- 著者
- Naoyoshi Kumakura*, Takayuki Motoyama, Keisuke Miyazawa, Toshihiko Nogawa, Julien Pernier, Katsuma Yonehara, Mayuko Sato, Yumi Goto, Kaori Sakai, Nobuaki Ishihama, Kaisei Matsumori, Pamela Gan, Kiminori Toyooka, Sandrine Lévêque-Fort, Hiroyuki Koshino, Takeshi Fukuma, Richard J. O’Connell, Ken Shirasu* *責任著者
- 掲載誌
- Science
- 掲載日
- 2026.02.12
- DOI
- 10.1126/science.aec9443
- URL
- https://www.science.org/doi/full/10.1126/science.aec9443

