肺がん治療標的タンパク質の全貌と 阻害薬による構造変化を解明!
金沢大学医薬保健研究域医学系呼吸器内科学/ナノ生命科学研究所(WPI-NanoLSI)の矢野聖二教授、WPI-NanoLSIの古寺哲幸教授、がん進展制御研究所ゲノム生物学研究分野/WPI-NanoLSIの酒井克也准教授らの共同研究グループは、肺がんの代表的な治療標的であるEML4-ALK融合タンパク質の全体構造を、世界で初めて高速原子間力顕微鏡で可視化しました。さらに、その阻害薬によってこのタンパク質の構造が変化し、そのことが抗腫瘍効果の一因となることを初めて明らかにしました。
EML4-ALK融合遺伝子(※1)は、共同研究者であり現国立がん研究センター理事長の間野博行博士らが2007年に発見した肺がんの約3%に検出される肺発がん遺伝子異常です。この異常遺伝子から作られるEML4-ALK融合タンパク質により発生した肺がんにはALKキナーゼ阻害薬が劇的な抗腫瘍効果を示すことが知られています。しかし、これまでEML4-ALK融合タンパク質の全体構造や動態は未解明であり、ALK阻害薬(※2)が構造にどのような影響を与えるのかも不明でした。
本研究グループは、EML4-ALK融合タンパク質の精製に世界で初めて成功し、ナノ生命科学研究所が開発している高速原子間力顕微鏡(HS-AFM)(※3)を用いて、その全体構造や動態をリアルタイムで観察することに成功しました。その結果EML4-ALK融合タンパク質は、紐状のEML4と球状のALKが結合した形態をとり、単体でも存在しますが二量体や三量体(オリゴマー)を形成することが明らかになりました。さらに、ALK阻害薬(アレクチニブ、ブリグチニブ、ロルラチニブなど)は紐状構造を持つEML4の畳み込みを引き起こし、EML4-ALK融合タンパク質の二量体化および三量体化を抑制することを見出しました。これらの結果から、ALK阻害薬はALKキナーゼ活性を抑制するほかに、EML4-ALKのオリゴマー化を抑制することで、抗腫瘍効果を発揮することが示唆されました。
本研究成果は、EML4-ALK融合タンパク質の構造の全貌を可視化し、ALK阻害薬の新しい抗腫瘍メカニズムを明らかにしたことで、今後の分子標的薬開発の起爆剤になることが期待されます。
本研究成果は、2026年1月20日(現地時間)に米国化学会機関誌『ACS Nano』にオンライン掲載されました。
【研究の背景】
肺がんは、年間約7.5万人が死亡する、日本におけるがん死亡原因の第一位です。その中で、EML4-ALK融合遺伝子は、共同研究者である現国立がん研究センター理事長の間野博行博士らが2007年に発見した肺がんの約3%に検出される肺発がん遺伝子異常です。この遺伝子異常によって発生した肺がんには、ALKキナーゼ阻害薬が劇的な抗腫瘍効果を示すことが知られています。
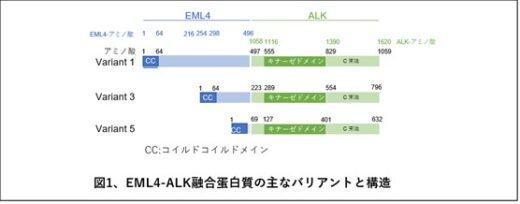
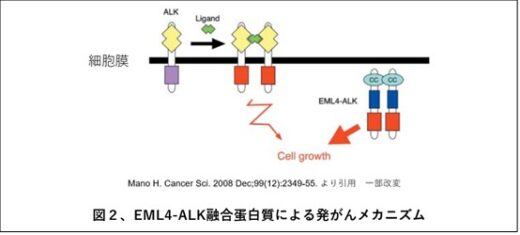
EML4-ALK融合遺伝子は、微小管関連遺伝子であるEML4とリンパ腫から発見されたALK遺伝子のそれぞれ一部が融合することで形成されます。その結果、正常では存在しない融合タンパク質が作られます。EML4部分の長さが異なる15種類以上のバリアント(同じタンパク質だがアミノ酸配列が異なるもの)があり(臨床的に頻度の高いものはバリアント1とバリアント3)(図1)、いずれのバリアントもEML4のN末端にある「コイルドコイルドメイン(CC)」と呼ばれる部位で結合し、二量体あるは三量体(両者をまとめてオリゴマーともいわれます)を形成することでALKキナーゼが活性化され、細胞ががん化すると考えられてきました(図2)。
しかし、EML4-ALK融合タンパク質がどのような形をしているのか?本当にオリゴマー(二量体や三量体)を形成しているのか?また、ALK阻害薬はALKキナーゼ活性を抑制することで抗腫瘍効果を発揮すると考えられていますが、EML4-ALK融合タンパク質の構造に変化を及ぼすのか?などは全く不明でした。
【研究成果の概要】
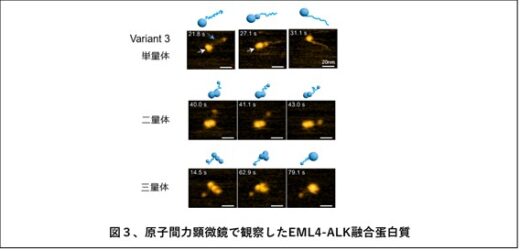
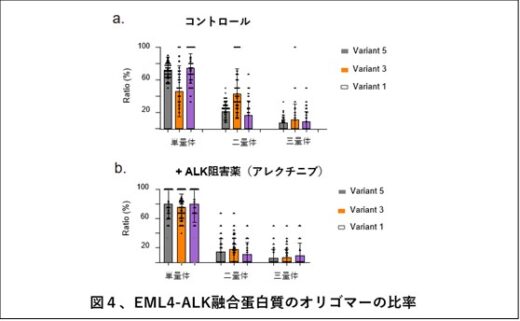
本研究では、EML4-ALK融合タンパク質を世界で初めて高純度に精製することに成功し、ナノ生命科学研究所のHS-AFMを用いて、その構造と動態をリアルタイムに観察しました。その結果、ALKキナーゼは3nmほどの球状構造を、EML4はそれにつながる細い紐状構造をしていることが明らかになりました。また、このEML4-ALK融合タンパク質は単量体だけでなく、EML4のN末端で結合した二量体や三量体としても存在することが確認されました(図3、図4a)。
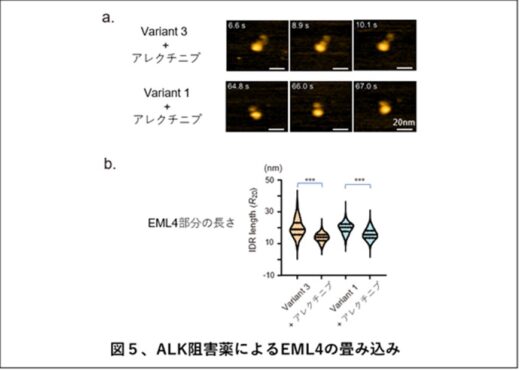
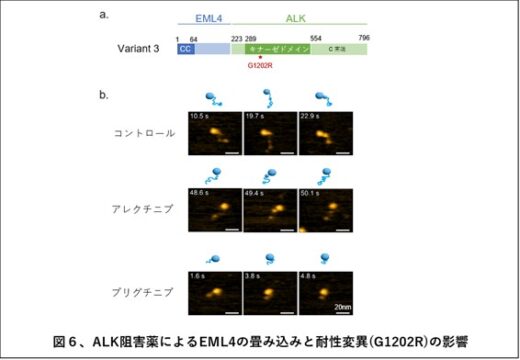
興味深いことに、ALK阻害薬(アレクチニブ、ブリグチニブ、ロルラチニブ)を1時間処理することにより、二量体や三量体のEML4-ALK融合タンパク質の割合が減少しました(図4b)。さらに注意深く観察すると、ALK阻害薬処理により紐状構造を持つEML4の畳み込みが起こり、その長さは縮んでいました(図5)。この構造変化は、ALK阻害薬アレクチニブの効果を無効にするALKキナーゼの耐性変異(G1202R)を導入(図6a)することによりみられなくなった(キャンセルされた)一方で、この耐性変異にも有効なALK阻害薬ブリグチニブではキャンセルされませんでした(図6b)。
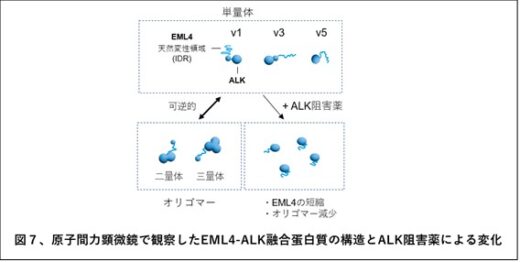
これらの結果から、EML4-ALKは単量体のほかにオリゴマーとして存在しますが、ALK阻害薬はALKキナーゼ活性を抑制するほかに、EML4部分の畳み込みを起こしてオリゴマー化を抑制することで、抗腫瘍効果を発揮することが示唆されました(図7)。
【今後の展開】
本研究成果は、EML4-ALK融合タンパク質の構造の全貌を初めて可視化し、ALK阻害薬の新しい抗腫瘍メカニズムを明らかにしたことで、今後の分子標的薬開発の起爆剤になることが期待されます。
用語解説
掲載論文情報
- 論文タイトル
- High-speed atomic force microscopy reveals disordered region-mediated structural plasticity of anaplastic lymphoma kinase-fusion protein induced by inhibitors. (高速原子間力顕微鏡によるALK阻害薬が惹起するALK融合タンパク質の天然変性領域を介した構造可塑性の解明)
- 著者
- Han Xujun、古寺哲幸、Yilmaz Neval、酒井克也、新井祥子、Li Borui、今村龍、Voon Dominic Chih-Cheng、福田康二、南條成輝、Flechsig Holger、間野博行、松本邦夫、矢野聖二
- 掲載誌
- ACS Nano
- 掲載日
- 2026.01.20
- DOI
- 10.1021/acsnano.5c17078
- URL
- https://pubs.acs.org/doi/10.1021/acsnano.5c17078

