記憶を司るタンパク質CaMKIIのリング構造の新発見
金沢大学自然科学研究科数物科学専攻博士後期課程の松島啓介、ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の柴田幹大教授らの研究グループは、自然科学研究機構生理学研究所の村越秀治准教授らの研究グループとの共同研究で、脳の記憶や学習に欠かせないタンパク質、カルシウム/カルモジュリン依存性キナーゼII(CaMKII)が12個のサブユニットから成るリング内でα型とβ型を同一リングに混在させ、隣接して配置することを高速原子間力顕微鏡(高速AFM、※1)を用いて世界で初めて明らかにしました。これにより、長年残されていたCaMKIIのリング構造に関する疑問に決着をつけました。
CaMKIIは、12個のサブユニットがリング状に集まって働いています。脳の神経細胞内のCaMKIIにはα型とβ型の2種類があり、脳の領域や発達段階でその存在比率が変わることが知られています。しかし、これまで一つのリングの中でα型とβ型が一緒に存在するかどうか、そして混ざるとすればどのように並んでいるのかは謎でした。本研究では、高速AFMという特殊な顕微鏡を使って、溶液中で動くCaMKIIのリアルタイム観察を行いました。その結果、CaMKIIの12量体リングの中にはα型とβ型が混ざっており、それぞれのサブユニットがα型とβ型のどちらに由来するかを識別することで、高確率で隣り合う配置をとることも明らかにしました。これにより、長い間未解決であったCaMKIIの真のリング構造の謎が解け、約40年にわたる疑問に終止符が打たれました。
これらの知見は、シナプスでのCaMKIIを介したシナプスの可塑性(シナプスの強さや結合が変化する仕組み)の分子基盤や分子メカニズムを理解するうえで重要な手がかりになると考えられます。将来的には、記憶、学習、認知などの脳機能をタンパク質といった分子レベルで明らかにすることにつながり、ひいてはアルツハイマー病などのさまざまな精神・神経疾患の臨床応用(治療薬)の開発にも貢献すると期待されます。
本研究成果は、2025年12月24日午前10時(英国時間)に英国科学雑誌『Nature Communications』のオンライン版に掲載されました。
【研究の背景】
私たちの記憶は、大脳皮質や海馬と呼ばれる脳部分の神経細胞ネットワークによって保存されています。この神経細胞同士がつながる場所は「シナプス」と呼ばれ、そこでは情報の伝達が行われています。シナプスの構造や性質が長期間にわたって変化することがあり、これを「シナプスの可塑性」と呼びます。例えば、シナプスの体積や受容体が増えたり減ったりすることで、情報伝達の効率が強くなったり弱くなったりします。この現象は、「長期増強(LTP)」や「長期抑圧(LTD)」と呼ばれ、記憶の形成や忘却の基盤になっていると考えられています。こうしたシナプスの変化を担う重要な分子の一つが、カルシウム/カルモジュリン依存性キナーゼII(CaMKII)という酵素です(図1)。CaMKIIには、同じ機能を持ちながら構造や性質が少し異なるアイソフォーム(※2)があり、脳の神経細胞ではα型とβ型が知られています。例えば、α型のCaMKIIが欠損したマウスは、場所の記憶障害が起きることが報告されており、記憶との直接的な関係性が示されています。一方、β型は神経発達や精神疾患(統合失調症やうつ病)への関与が示されており、これらの異なるCaMKIIが脳機能の制御において重要な役割を担っています。
興味深いことに、神経細胞内にあるCaMKIIのα型とβ型の比率は、脳の部位によって大きく異なることが報告されています。例えば、前脳ではα型:β型の比率が3:1であるのに対し、小脳では逆に1:4と、全く反対の比率です。さらに、発達の過程でもこの比率は変化し、生後10日のマウスでは1:1の割合で存在しています。ここで、CaMKIIは主に12個のサブユニットが集まってできた多量体(複合体)として存在しますが(図1)、その多量体はサブユニットが全て同じ(α型またはβ型)であるホモ多量体なのか、それともα型とβ型が混ざったヘテロ多量体なのか、長い間議論の的となっていました。CaMKIIは神経細胞内で働く酵素ですが、どの場所(局在)で働くかも非常に重要なポイントです。これまでの研究によると、β型のCaMKIIだけが細胞骨格の一つであるF-アクチンと結合できることが分かっています。もしCaMKIIがα型だけのホモ多量体と仮定すると、F-アクチンと結合できず、F-アクチンの枝分かれが多いシナプス付近に局在させることは難しいと考えられます。一方、α型とβ型が混ざったヘテロ多量体であれば、α型はβ型に連れられてシナプス近傍への局在が可能となります。こうした性質は、LTPやLTDとも関係しており、CaMKIIがF-アクチンと結合と解離を繰り返しながら、シナプスの体積変化を引き起こすとも言われています。このように、CaMKII多量体の正確な構成を解明することは、シナプスの可塑性を分子レベルで理解する上で非常に重要です。
【研究成果の概要】
CaMKII 12量体内のサブユニットが、α型とβ型のどちらに由来するのかを調べるには、ナノメートルスケールのタンパク質そのものを直接イメージングするのが最も確実です。そこで私たちは、高速AFMを使って、CaMKII の1分子イメージングを試みました。以前の研究で、α型のCaMKIIホモ多量体に対して高速AFMを適用し、キナーゼドメインの活性化状態依存的なダイナミクスを可視化することに成功しています(S. Tsujioka et al. Sci. Adv. 2023)。本研究では、前脳の存在比(α型:β型 = 3:1)を模擬したCaMKIIを哺乳類細胞(HEK293)に過剰発現し、単離精製した試料に対して0.3 秒の時間分解能で高速AFM観察を行いました。その結果、CaMKIIの12量体リング構造内に、α型とβ型が混ざった「ヘテロ多量体」が形成されていることが分かりました。しかも、量的に少ないβ型は、80%以上の確率で隣り合って並んでいることも判明しました(図2)。さらに、CaMKIIが活性化した状態(カルシウム/カルモジュリン(Ca2+/CaM)結合状態やThr286のリン酸化状態)では、12個のサブユニットの中で、特に隣り合ったβ型同士が安定したキナーゼドメイン複合体を作り出すことを発見しました(図3)。生化学実験から、β型はα型よりもキナーゼ活性能が低いことが分かりましたが、脱リン酸化酵素に対しては耐性が同じだという事実も判明しました。つまり、この特別なキナーゼドメイン複合体は、CaMKIIの酵素としての働きは抑えるものの、LTPの誘導に必須な部位(Thr286やグルタミン酸受容体、 NMDARへの結合部位(T-site))を露出した構造ということが示唆されます。また実際に、Ca2+/CaMが解離した後も、β型が形成するキナーゼドメイン複合体は長時間活性化構造を保つことが分かり、LTPの分子メカニズムを理解するカギとなる可能性があります。
今回の研究で、CaMKII はα型とβ型のサブユニットが混ざり合ったヘテロ多量体を形成することを突き止めました。これらの発見と、既知の知見を組み合わせて、新しいモデルを提唱しました(図4)。特に、β型が隣り合ってリング状に並ぶ構造が、F-アクチンへの結合や、活性化状態でのNMDARへの結合を促進する仕組みを示しています(図4)。これらの結果は、分子の姿を直接可視化できる高速AFMでしか捉えることができないものであり、これまでの多様な実験データに新たな解釈をもたらす可能があります。
【今後の展開】
本研究で明らかとなったCaMKIIの真のリング構造は、CaMKIIを介したシグナル伝達のメカニズムをより正確に理解するための重要な分子基盤となります。これにより、記憶や学習の仕組みを分子レベルで解明するだけでなく、精神や神経の病気に対する新しい治療薬の開発にもつながる可能性があります。ただし、高速AFM観察は、あくまでin vitro(試験管内)環境での観察であるため、実際の神経細胞内で同じ現象が起きているかは、さらなる検証が必要です。また、シナプスを構成するタンパク質は数百種類も存在しています。記憶の形成や忘却といった複雑な現象を分子レベルで理解するには、CaMKIIだけでなく他のシナプスタンパク質の働く姿や、CaMKIIと協働して作用する姿も明らかにしなければなりません。私たちの持つユニークな高速AFM技術はその一端を担える可能性を秘めており、今後の研究のさらなる進展が期待されます。
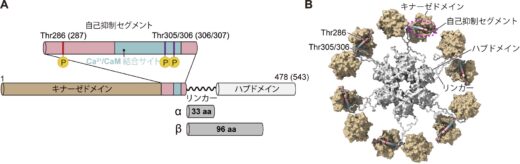
図 1:CaMKIIのドメイン構成。(A)括弧内の数字はβ型のアミノ酸残基を示す。α型とβ型の主な違いはリンカーのアミノ酸残基数である。電子顕微鏡画像に基づいて予想されたCaMKIIαの12量体構造モデル(B)。

図 2:CaMKIIα/βヘテロ多量体の連続する高速 AFM画像。中央にハブ集合体が存在し、その周囲をキナーゼドメインが自由に動く様子が観察された。α型とβ型の判定は、ハブ集合体からの距離と運動性で判断できる。原著論文では動画を見ることができる。

図 3:CaMKIIβホモ多量体のリン酸化活性化状態の連続する高速 AFM画像。キナーゼドメイン複合体(KD複合体、 青色破線)の形成が観察された。原著論文では動画を見ることができる。
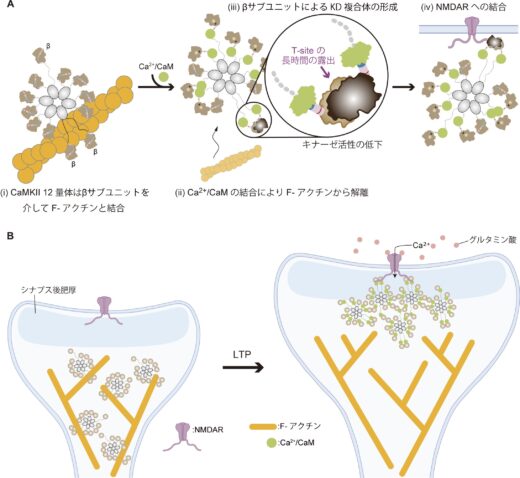
図4:高速AFM観察より明らかとなったCaMKIIα/βヘテロ12量体のF-アクチンへの結合モデル(A)とLTP誘導時に起こるスパイン内でのCaMKIIの局在化モデル(B)。12量体内のβ型の隣接により基底状態でF-アクチンと結合し、LTP誘導時にはNMDARとの結合が促進される。
用語解説
掲載論文情報
- 論文タイトル
- Structural dynamics of mixed-subunit CaMKIIα/β heterododecamers filmed by high-speed AFM (高速AFMを用いたCaMKIIα/βが混合したヘテロ12量体のナノ動態イメージング)
- 著者
- Keisuke Matsushima, Takashi Sumikama, Taisei Suzuki, Mizuho Ito, Yutaro Nagasawa, Ayumi Sumino, Holger Flechsig, Tomoki Ogoshi, Kenichi Umeda, Noriyuki Kodera, Hideji Murakoshi, and Mikihiro Shibata (松島啓介、炭竈享司、鈴木大晴、伊藤泉帆、長澤裕太郎、角野歩、ホルガー・フレクシグ、生越友樹、梅田健一、古寺哲幸、村越秀治、柴田幹大)
- 掲載誌
- Nature Communications
- 掲載日
- 2025.12.24
- DOI
- 10.1038/s41467-025-66527-9
- URL
- https://www.nature.com/articles/s41467-025-66527-9

