抗原特異的な制御性T細胞を生体内で誘導する改変エクソソームを開発
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/医薬保健研究域医学系免疫学の華山力成教授、山野友義准教授、大学院新学術創成研究科ナノ生命科学専攻/ナノ精密医学・理工学卓越大学院プログラム(WISE)履修者の今井翔太(博士後期課程3年)らの研究グループは、細胞から分泌される微小な膜小胞「エクソソーム/細胞外小胞(Extracellular Vesicles: EVs)」を人工的に改変し、疾患関連抗原に特異的な制御性T細胞(Regulatory T cell: Treg)(※1)を誘導する「抗原提示エクソソーム(Antigen-Presenting EV: AP-EV-Treg)」の開発に成功しました。
本研究グループはこれまでに、がん免疫領域で改変エクソソームを開発し、キラーT細胞やヘルパーT細胞を抗原特異的に活性化する方法を報告してきました。今回は、その発展形として、同じ改変エクソソーム技術を基盤に、免疫制御分子の組み合わせを変えることによって、免疫「活性化」から免疫「抑制」へと、相反する免疫反応を精密に制御する技術を確立しました。
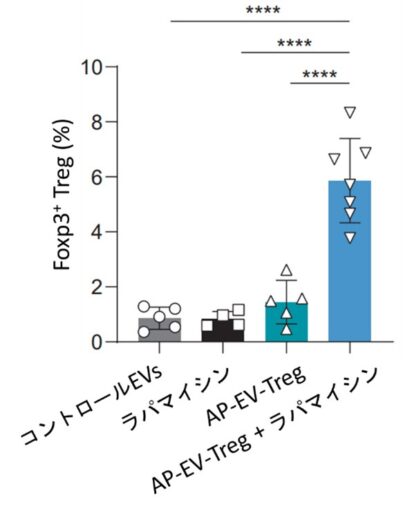
AP-EV-Tregは、膜表面にペプチド–MHCクラスII複合体(pMHCII)とIL-2、TGF-βを同時に提示し、試験管内でナイーブCD4⁺T細胞からの抗原特異的Treg分化と増殖、および機能的な抑制活性を実証しました(図1、2、3)。さらに、マウス体内ではmTOR阻害剤ラパマイシンとの併用により、抗原特異的Tregの誘導が有意に増強されることを示しました(図4)。
本成果は、自己免疫疾患(※2)やアレルギー疾患など、過剰な免疫反応の制御を必要とする疾患領域に対し、次世代免疫制御プラットフォームとしての応用を切り拓くものです。
本研究成果は、2025年12月18日(日本時間)に、国際学術誌『Drug Delivery』に掲載されました。
【研究の背景】
自己免疫疾患は世界中で増加し続けており、その根本的な治療は確立されていません。現在広く用いられている治療法は、ステロイドや免疫抑制剤による対処療法が中心ですが、これらは免疫系全体を抑制するため、感染症リスクやがん化の危険性が高まるという副作用が避けられません。従って、病因抗原のみに反応する“抗原特異的免疫抑制”を人工的に再構築することが免疫学・臨床医学の長年の課題となっていました。
免疫制御の主役の一つである制御性T細胞(Treg)は、自己免疫疾患の発症防御に中心的な役割を果たします。Tregを外部から補う、あるいは体内で選択的に誘導することは、自己免疫疾患の有望な治療戦略と考えられてきました。近年、mRNA技術やナノ粒子を用いたTreg誘導法が報告されていますが、これらは免疫原性やオフターゲット作用といった課題を抱えており、より安定で安全なプラットフォームの開発が求められていました。
エクソソームは、生体由来であることから高い生体適合性と低い免疫原性を兼ね備え、抗体医薬やmRNA医薬に比べても複数分子の同時提示や標的細胞への自然送達が可能です。これにより、より精密かつ柔軟な免疫制御や標的治療の実現が期待されています。
【研究成果の概要】
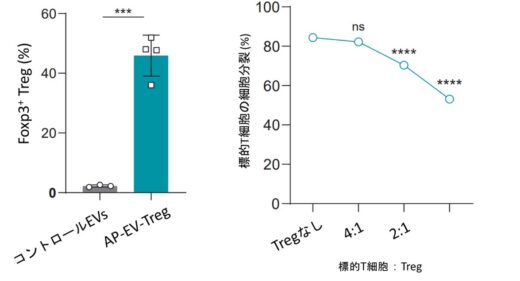
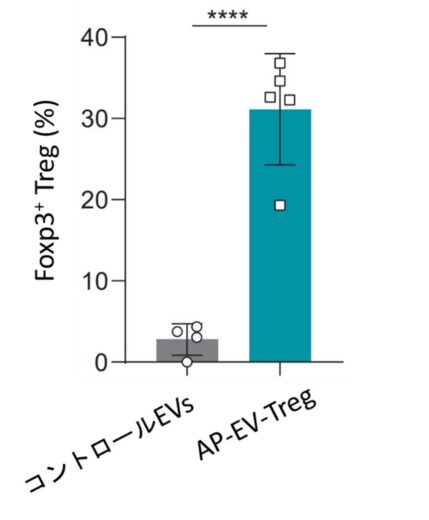
Tregの発達には、T細胞受容体による抗原認識に加え、IL-2とTGF-βという2つのサイトカインが不可欠であることが知られています。本研究では、この生理的分化条件を再現するため、抗原提示分子 pMHCII と IL-2・TGF-β を一つのエクソソーム上で同時に提示できる改変エクソソーム「AP-EV-Treg」を開発しました(図1)。培養細胞を用いた実験では、AP-EV-TregをOVA抗原特異的T細胞と共培養することで、Tregへの強力な分化誘導が確認されました。誘導されたTregは、免疫抑制分子を高発現し、他のT細胞の増殖を用量依存的に抑制することが示されました(図2)。また、多発性硬化症の発症に深く関与することが知られているMOG抗原を搭載したAP-EV-Tregを用いたところ、MOG特異的T細胞からもTregが効率的に誘導されることが確認されました(図3)。これにより、AP-EV-Tregが実際の自己免疫関連抗原を標的とする寛容誘導系として機能し得ることが示されました。
さらにin vivo実験では、マウスにAP-EV-Tregを投与することで、抗原特異的T細胞が選択的に活性化され、mTOR経路阻害剤ラパマイシンとの併用によって抗原特異的Tregの誘導が顕著に増強することが明らかになりました(図4)。これまでの多くの研究では、生体外でTregを誘導して細胞治療に応用する戦略が報告されているのに対し、本研究は抗原特異的T細胞を“生体内でTregへ転換する”ことを可能にした点で大きく異なります。
これらの成果は、従来の全身免疫抑制療法とは異なり、疾患抗原にのみ選択的に作用する新しい免疫制御戦略の確立を意味します。特定抗原に応答するT細胞をTregへと転換することで、自己免疫疾患の新しい治療法になる可能性があります。
【今後の展開】
本研究では、抗原特異的Tregを誘導するために、分子構成を自由に組み替え可能なモジュール型エクソソームプラットフォームを開発し、自己免疫疾患およびアレルギー疾患に対する新しい免疫制御療法の可能性を示しました。今後は、(1)PD-L1など抑制分子のAP-EV-Treg内蔵化による薬剤非依存型の改変、(2)Tregの安定化・持続化に向けた設計改良、(3)標的組織指向性や抗原最適化の体系的検証、および(4)製造スケールアップ時の品質一貫性と反復投与時の安全性の評価を進め、臨床応用に向けた基盤整備を加速します。AP-EV-Tregの設計自由度の高さは、疾患や患者ごとに異なる標的抗原や病態環境に対応したオーダーメイド免疫療法への展開を可能にすることが期待されます。
用語解説
掲載論文情報
- 論文タイトル
- Induction of Antigen-Specific Regulatory T Cells by Engineered Extracellular Vesicles (改変型細胞外小胞による抗原特異的制御性T細胞の誘導)
- 著者
- Shota Imai†, Kanto Nagamori†, Uryo Onishi, Xiabing Lyu, Iriya Fujitsuka , Makie Ueda, Tomoyoshi Yamano*, and Rikinari Hanayama* (今井翔太†、永森幹人†、大西有亮、呂夏氷、藤塚偉利哉、上田真喜栄、山野友義*、華山力成*) †:筆頭著者 *:責任著者
- 掲載誌
- Drug Delivery
- 掲載日
- 2025.12.18
- DOI
- 10.1080/10717544.2025.2586305
- URL
- https://doi.org/10.1080/10717544.2025.2586305


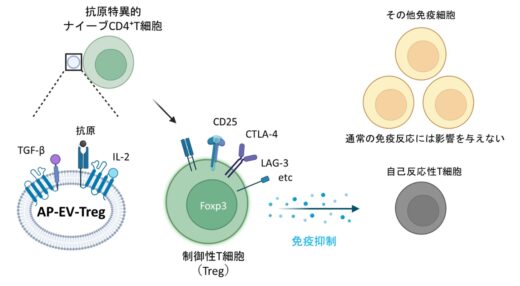
Tregは、IL-10やTGF-βなどの抗炎症性サイトカインや、CTLA-4やPD-L1などの免疫抑制分子を用いて免疫細胞の活性化を抑えたり、他の免疫細胞が増殖するために必要なIL-2を調整したりすることで、多段階的に免疫を鎮静化します。Tregが不足したりうまく働かなくなったりすると、自己免疫疾患が発症しやすくなることが分かっています。