細胞内のATP濃度を決定できる 蛍光寿命型センサーの開発に成功
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の新井敏教授、ブー・クアン・コン特任助教、シンガポールA*STARの伊藤秀城上級研究員(研究当時)とレーン・エレン主席研究員(研究当時)、東京科学大学総合研究院 化学生命科学研究所の北口哲也准教授らの共同研究グループは、ATP濃度を「蛍光寿命」(※1)という蛍光タンパク質の光学的特性に変換して測定できる、新しい蛍光センサーを開発しました。
私たちの体を構成する最小単位「細胞」では、さまざまな化学反応が起こっており、その“燃料”として働くのが、ATP(アデノシン三リン酸)です。ATPは「エネルギーの通貨」とも呼ばれ、細胞活動の根幹を支えています。そのため、細胞内のどこに、どのくらいのATPが存在するのかを正確に測定することは、生命現象の理解に不可欠です。
これまで、細胞内の標的分子の濃度変化は、蛍光の明るさ(蛍光輝度)の変化として検出するセンサーが広く用いられてきました。しかしこの手法では、細胞の形状やセンサーの導入量、励起光の強度などの影響を強く受けるため、定量的な解析が困難という課題がありました。本研究では、この課題を克服するため、前述の要因の影響を受けにくい「蛍光寿命」という頑強な光学パラメーターを導入しました。ATP濃度を蛍光寿命値に変換できるセンサーを開発し、ATP濃度と蛍光寿命値の対応関係(検量線)を用いた定量的な比較を可能にしました。これにより、細胞ごとのATP濃度の違いを正確に評価できるようになりました。
この手法を用いて疾患細胞を解析したところ、ミトコンドリア病(※2)患者由来の細胞では、ミトコンドリア内のATP濃度が健康な細胞に比べて低いこと(防衛医科大学・大澤らとの共同研究)、悪性度の高いがん細胞ほど細胞質内のATP濃度が高いことが明らかとなりました(金沢大学ナノ生命科学研究所/がん進展制御研究所・中山、大島らとの共同研究)。
本研究は、細胞内エネルギーの定量イメージングに新たな道を拓く成果です。今後、この技術は、がん、神経疾患、代謝異常など、細胞エネルギー異常が関与する多くの疾患研究への応用が期待されます。
本研究成果は、2025年11月13日(英国時間)に英国科学誌『Nature Communications』のオンライン版に掲載されました。
【研究の背景】
細胞1個の内部では、分子レベルの複雑な生命現象が絶えず起こっています。これらの現象を効率良く動かすための“燃料”に相当する分子が、ATPと呼ばれる物質で、「エネルギーの通貨」とも呼ばれています。このATPの濃度を、細胞1個単位、さらには細胞小器官レベルの解像度で観察することは、生命現象の理解において極めて重要です。
近年、蛍光タンパク質を利用したバイオセンサーの開発が世界的に進展し、生命現象の可視化に大きく貢献しています。これらのセンサーは、プラスミドDNA(※3)を介して容易に共有・導入できるため、世界中の研究者が同じツールを使って、細胞内の分子動態を研究できる点も大きな利点です。蛍光センサーの多くは、標的とする分子の濃度変化に応じて、蛍光の明るさ(輝度)が変化する「輝度変化型蛍光センサー」と呼ばれるタイプです。これまでに、細胞内外のATPを検出できる輝度変化型のセンサーも複数報告されてきました。
現在では、ATPに限らず、世界中で激しい競争のもと輝度変化型蛍光センサーの開発が進んでおり、その種類は数百を超えるとも言われています。こうした輝度変化型蛍光センサーは、顕微鏡観察下で、細胞内の標的とする分子の濃度が、「上昇・下降した」といった定性的な解析を得意とします。その反面、蛍光の明るさのみから、標的分子の絶対濃度を直接求めることはできません。これは、細胞ごとに蛍光の初期輝度が異なるため、その違いが標的とする分子濃度によるものなのか、センサー分子の発現量によるものなのかを区別できないことが原因です。また、センサーの発現量以外にも、励起光の強度、焦点ズレ、光褪色などの要因によって、取得されるデータは強く影響を受けます。こうした課題に対して、異なる波長の蛍光を用いたレシオ測定(※4)によって、上記の要因を補正する手法もあります。しかし、この方法で得られたレシオ値は、使用する顕微鏡や測定環境が少しでも異なると再現が難しく、異なる研究室や実験日をまたいで結果を比較・議論することは極めて困難でした。そのため、「細胞内でどれだけの分子が、どの場所に存在しているのか」を正確に数値化する定量解析は、蛍光センサー開発において、大きな課題の1つとされてきました。
【研究成果の概要】
本研究グループは、従来の輝度変化の代わりに、細胞内の標的分子の濃度を蛍光寿命値に変換できる蛍光センサーを着想しました(図1)。蛍光寿命は、上記の輝度変化型センサーで課題となる複数の要因の影響を受けにくい、安定性の高い物理量です。ここで、蛍光寿命値と細胞内の標的分子の濃度情報と1対1で紐付けることができれば、信頼度の高い検量線を用いて細胞内の分子濃度を決定することが可能になります(図1下段の検量線:X [ns]=Y [M])。本研究グループは、細胞内のATPの濃度を蛍光寿命に変換できる新しいバイオセンサーを作ることに成功しました。このセンサーにより、定量性が著しく向上したことで、さまざまな細胞種間のATP濃度を比較することが可能になりました。例えばミトコンドリア病では、ミトコンドリアの大事な機能の1つであるATP産生能に異常をきたしていることが予想されますが、実際、ミトコンドリア病患者では健常者の細胞に比較してミトコンドリアのATP濃度が低くなっていることが示唆されました(防衛医大との共同研究)。この差は0.3mM程度とわずかですが、本センサーにより検出可能であることが実証されました(図1下段)。また、がん治療において、転移能の高いがん細胞は、悪性度が高いとされます。今回、金沢大学がん進展制御研究所との共同研究で、悪性度の高いがん細胞において細胞質のATP濃度が高いことが明らかとなりました(図2)。さらに、培養した細胞だけでなく、多細胞から構成されるショウジョウバエの脳におけるATP濃度分布の可視化にも成功しています(図3:金沢大学・木矢剛智准教授との共同研究)。
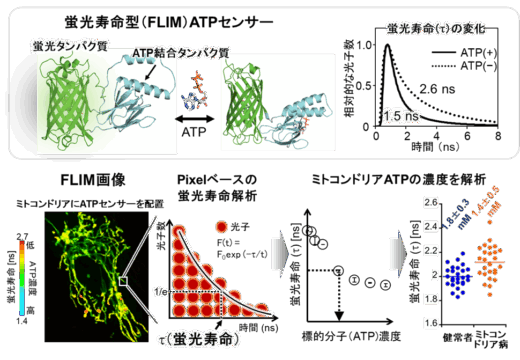
図1. ATP濃度を蛍光寿命に変換できるATPセンサー(qMaLioffG)。検量線(蛍光寿命と ATP濃度)を用いて、ピクセル毎の蛍光寿命値を算出、ATP濃度情報を得ることができる。ミトコンドリア病によってATP産生能に障害がある細胞のATP濃度を定量解析した(出版社から許可を得て掲載論文の図を改変)。
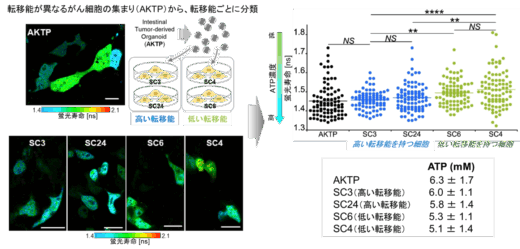
図2. 転移能(悪性度)の異なるがん細胞のATPの定量解析。転移能が高いがん細胞では、低い細胞と比べて、ATP濃度が高いことが示唆された(出版社から許可を得て掲載論文の図を改変)。
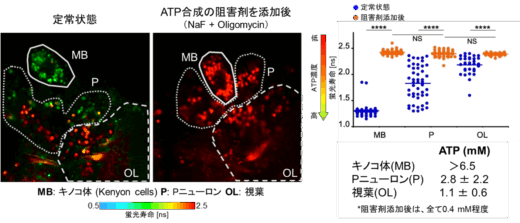
図3. ショウジョウバエの脳におけるATPマッピングの事例(出版社から許可を得て掲載論文の図を改変)。
なお、本研究成果では、JST創発的研究支援事業による融合研究の成果が複数含まれています。例えば、ATPセンサーのデモンストレーションを実施する際、ショウジョウバエのイメージングのノウハウは、金沢大学の木矢剛智准教授によって提供されました(阿部パネル)。また今回、がん細胞のスフェロイド状のサンプルを調製してイメージングを行いましたが、東京科学大学の藤枝俊宣教授らのチームから提供されたものです(北川パネル)。さらに、ATP結合に伴って、蛍光寿命が変化するメカニズムの解明においては、過渡吸収スペクトル解析で片山哲郎准教授(北川パネル)が大きく貢献しました。
【今後の展開】
本研究で開発した蛍光寿命型のバイオセンサー作りのノウハウは、ATP以外への分子にも適用可能です。現在、蛍光バイオセンサーによって世界中でデータが取得されているにも関わらず、定性的な議論しかできておらず、世界中で積み重なっていくデータを目の当たりにしながら、比較ができない状態です。本研究成果を基盤として、さまざまなバイオセンサーが作られれば、細胞内のシグナル分子に関わる膨大な定量データの取得が可能となります。これにより、情報科学分野との連携によって、今までになかった新しい細胞内の代謝やシグナル伝達に関わるビックデータの創出が期待されます。こうしたデータは、あらゆる生命科学の謎解きや疾患メカニズムの理解、さらには創薬研究への応用などに資するものと期待されます。
用語解説
掲載論文情報
- 論文タイトル
- qMaLioffG: a genetically encoded green fluorescence lifetime-based indicator enabling quantitative imaging of intracellular ATP (qMaLioffG: 細胞内のATPを定量的に可視化する遺伝子コード型の蛍光寿命バイオセンサー)
- 著者
- 新井敏、伊藤秀城、ブー・クアン・コン、グエン・ローン・ティ・ゴック、中山瑞穂、大島正伸、森田敦也、岡本和子、奥田覚、寺西亜生、大澤麻登里、田村義輝、野々山恵章、田熊めぐみ、藤枝俊宣、サティア・ランジャン・サルケア、タンキア・スダハラン、古部昭広 、片山哲郎、木矢剛智、レーン・エレン、北口哲也
- 掲載誌
- Nature Communications
- 掲載日
- 2025.11.13
- DOI
- 10.1038/s41467-025-64946-2
- URL
- https://www.nature.com/articles/s41467-025-64946-2

