クロマチン制御分子(CHD1)の液滴形成が細胞運命を制御する ―がんの新たな分子メカニズムを解明―
私たちの細胞内では、DNAがヒストンというタンパク質に巻きつき、クロマチンという高次構造をとることで、必要な遺伝子だけが働くように制御されています。このクロマチン構造を動的に組み替えるのが「クロマチンリモデラー」※1と呼ばれるタンパク質群です。その一つであるCHD1は、がん抑制や幹細胞の分化制御に重要な役割を果たしています。これまで、前立腺がんなどでCHD1の遺伝子変異が報告されていましたが、CHD1がどのような分子機構でがん抑制に関与するのかは不明でした。また、CHD1が一定の構造を持たない柔軟な領域(IDR:intrinsically disordered region)※2を有し、脂質膜に包まれずに液滴のような凝縮体を形成する性質があることも、これまで知られていませんでした。
金沢大学医薬保健研究域博士課程の塚本康寛、がん進展制御研究所/ナノ生命科学研究所(WPI-NanoLSI)の酒井克也准教授、新学術創成研究機構/医薬保健研究域医学系の西山正章教授、ナノ生命科学研究所(WPI-NanoLSI)の福間剛士教授、古寺哲幸教授、松本邦夫特任教授らの研究グループは、CHD1のC末端IDRが液滴状凝縮体の形成に不可欠であり、この凝縮体の中にRNAやエピジェネティック因子※3が効率的かつ選択的に集積することで、遺伝子発現のON-OFFが適切に制御されることを明らかにしました。また、IDRを欠損した変異型CHD1では発がん関連遺伝子の異常発現と腫瘍形成が起こる一方、IDRを回復させることでこれらの異常が抑制されることも確認されました。
これらの成果は、CHD1がIDRを介して液滴状凝縮体を形成し、その集合体が遺伝子発現制御および腫瘍抑制に不可欠であることを初めて示したものです。本研究は、クロマチンリモデラーが「相分離」という物理的原理に基づいて機能するという新しい概念を提示し、がんにおけるクロマチン異常の理解に新たな視点をもたらしました。
本研究成果は、2025年10月30日に英国発行の国際学術誌『Nature Communications』オンライン版に掲載されました。
【研究内容と成果】
CHD1はヌクレオソームの配置を調整し、遺伝子発現を制御する代表的なクロマチンリモデラーであり、特に前立腺がんでの異常が報告されています。本研究では、がんで頻発するCHD1遺伝子のE1321フレームシフト変異に注目しました。研究グループは、この変異によりCHD1のC末端にある一定の構造を持たない柔軟な領域(IDR)が欠損すること、IDRがCHD1の液滴状凝縮体形成や遺伝子制御、がん抑制に不可欠であることを明らかにしました。
精製したCHD1タンパク質を試験管内で観察したところ、IDRを介して分子同士が弱く結びつき、液滴状の凝縮体を形成することが確認されました。さらに、高速原子間力顕微鏡(HS-AFM)による単一分子観察では、CHD1のC末端がひも状のIDRであることが明らかになり、高解像度AFM(HR-AFM)では、凝縮体が柔軟に変形しつつも一定の形を保つことが分かりました。これにより、クロマチンリモデラーが単一分子レベルで液滴のように振る舞う様子を初めて直接捉えることができました(図1)。
凝縮体内部の分子解析では、長鎖ノンコーディングRNA(lncRNA)※4やエピジェネティック因子が多く含まれており、これらが遺伝子活性化やクロマチン構造の調整に関与することが示唆されました(図2)。また、C末端IDRが欠損したCHD1を発現するヒト前立腺がん細胞では、発がん関連遺伝子の異常な発現プロファイルが観察されました。実際にIDRを欠損したCHD1を発現する前立腺がん細胞は、マウスで大きな腫瘍を形成したのに対して、IDR部分を人為的にCHD1に戻すと、腫瘍の増殖や発がん関連遺伝子の異常は抑制され、CHD1の凝集性が遺伝子発現制御と腫瘍抑制に不可欠であることが示されました(図3)。
これらの結果から、CHD1はIDRを介して液滴状凝縮体を形成し、その内部でRNAや制御因子を集積することでクロマチン上の遺伝子制御を行うことが明らかになりました。今回の発見は、クロマチンリモデラーがIDRによる動的集合、すなわち液滴形成を通じて機能するという新しい制御機構を示すものです。
【今後の展開】
今後は、CHD1以外のクロマチンリモデラーでも同様の液滴的な振る舞いが見られるかを検証し、lncRNAやエピジェネティック因子などの分子との相互作用を詳しく調べることで、クロマチン構造を柔軟に制御する普遍的な原理の解明が期待されます。また、CHD1凝縮体に集まる分子ネットワークを解析することで、遺伝子制御やクロマチンの安定性の全体像を把握でき、がんや細胞分化異常に共通するクロマチン異常の分子メカニズムの理解にもつながると考えられます。
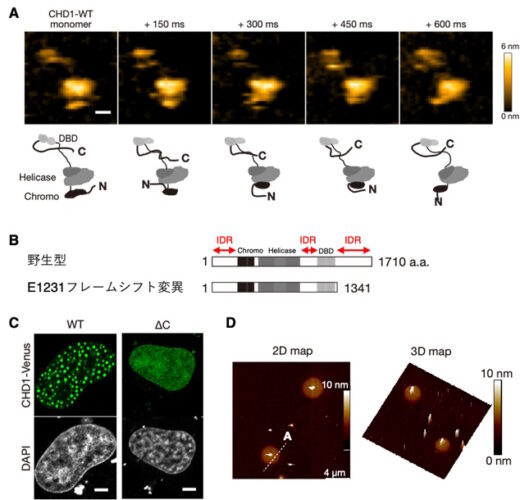
図1. CHD1の構造的特徴と凝縮体形成の可視化 CHD1タンパク質をHS-AFM(高速原子間力顕微鏡)で1分子レベルに観察した結果、N末端、C末端、中央部に柔軟で構造が定まらないひも状領域(IDR)が存在することが明らかになった(A)。がんで頻発するE1321フレームシフト変異では、このC末端IDRが欠失する(B)。細胞核内では、IDRを介してCHD1が液液相分離による凝縮体を形成することが観察された(C)。さらに、in vitroで精製したCHD1をHR-AFM(高分解能原子間力顕微鏡)で観察すると、凝縮体は厚みのある柔らかな円盤状構造をとることが示された(D)。本図はTsukamoto et al. (Nature Communications, 2025)掲載図を改変したものです(CC BY 4.0)。
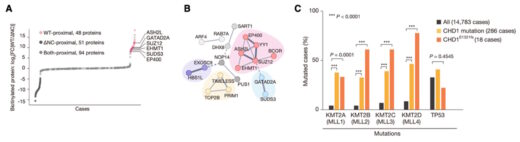
図2. CHD1凝縮体に依存して結合するタンパク質とその意義 CHD1の凝縮性に依存して結合するタンパク質群(A, ピンク)には、遺伝子の活性化や抑制に関与するヒストン修飾関連タンパク質(B)が含まれていた。その中でもASH2LはKMT複合体の構成因子であり、KMT酵素の変異はCHD1変異を有するがん症例で有意に共起することが確認された(C)。これらの結果から、CHD1とKMT複合体の協調的な機能異常が発がんに寄与する可能性が示唆された。本図はTsukamoto et al. (Nature Communications, 2025)掲載図を改変したものです(CC BY 4.0)。
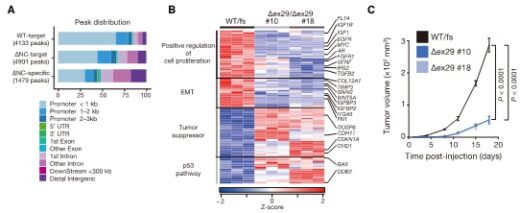
図3. CHD1の凝集能は遺伝子発現制御と腫瘍抑制に必須である CHD1が自ら凝縮体を形成する性質(凝集性)は、遺伝子発現を制御するゲノム上のプロモーター領域への局在に重要であることが示された(A)。がんで頻発するE1321フレームシフト(fs)変異によりC末端IDRが欠損したCHD1を発現するヒト前立腺がん細胞は、発がん関連遺伝子の異常な発現プロファイルを示し(B)、ヌードマウス移植モデルでは腫瘍の増殖が観察された(C)。一方、欠損したIDRを回復させると、腫瘍の増殖および発がん関連遺伝子の発現異常が抑制された(B、C)。本図はTsukamoto et al. (Nature Communications, 2025)掲載図を改変したものです(CC BY 4.0)。
用語解説
掲載論文情報
- 論文タイトル
- Condensation-dependent interactome of a chromatin remodeler underlies tumor suppressor activities (参考訳:クロマチンリモデラーの凝縮体依存的相互作用ネットワークが腫瘍抑制活性の基盤となる)
- 著者
- Yasuhiro Tsukamoto, Atsuki Kawamura, Ayhan Yurtsever, Hidefumi Suzuki, Nichole Marcela Rojas-Chaverra, Hiroki Sato, Daisuke Ino, Takehiko Ichikawa, Weilin Wei, Shojiro Haji, Dominic Chih-Cheng Voon, Akinobu Matsumoto, Kunio Matsumoto, Hidehisa Takahashi, Noriyuki Kodera, Takeshi Fukuma, Yoshihiro Ogawa, Masaaki Nishiyama, Katsuya Sakai
- 掲載誌
- Nature Communications
- 掲載日
- 2025.10.30
- DOI
- 10.1038/s41467-025-64655-w
- URL
- https://www.nature.com/articles/s41467-025-64655-w

