生きた細胞内の「核の硬さ」を直接測定することに成功 ―核の硬さはクロマチンの凝集状態で決まる可能性―
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の市川壮彦特任助教、河野洋平研究員、志見剛特任准教授、福間剛士教授、がん進展制御研究所の平田英周教授らの共同研究グループは、原子間力顕微鏡(AFM)(※1)を基盤として独自に開発したナノ内視鏡原子間力顕微鏡(ナノ内視鏡AFM)を用いて生きた細胞内部の核の硬さを直接的にナノスケールで計測し、その分布を可視化することに世界で初めて成功しました。
がん細胞の核の硬さは、悪性度や転移能と関係する重要な指標の一つと考えられています。しかし、従来の細胞外からの測定や細胞から取り出した核の測定では、生きた状態の核の硬さを正確に測定することは困難でした。
そこで、本研究では極細の探針を使用することによって生きた細胞内の構造を可視化するナノ内視鏡AFM法を応用することにより生きたがん細胞内の核の硬さを直接測定する技術を確立しました。この方法を用いて、がんの転移に関わる「上皮間葉転換(EMT)」(※2)の誘導による影響を測定したところ、EMTが起こると細胞核が柔らかくなることを発見しました。さらに、この核の硬さの変化は、核膜を裏打ちするラミンタンパク質の発現量とは相関せず、DNAが折りたたまれた構造体であるクロマチン(※3)の凝集度と強く相関していることを突き止めました。
これらの知見は、核の硬さを指標とした新たながん診断技術の開発や、細胞内小器官の力学的な役割の解明につながることが期待されます。
本研究成果は、2025年10月12日に国際学術誌『ACS Applied Nano Materials』のオンライン版に掲載されました。
【研究の背景】
細胞の最も重要な小器官である核の変形は、がんの悪性度を示す指標の一つと考えられています。そのため、核の物理的な性質、特に硬さ(弾性率)を正確に測定することは、がんの診断において重要です。しかし、従来の原子間力顕微鏡(AFM)では細胞膜の上から核を測定するため、細胞膜や細胞骨格の影響を分離できず 、また、細胞から取り出した裸の核の測定では、生きた細胞内での本来の状態を反映していないという課題がありました。従って、生きた細胞内で、ありのままの核の硬さを正確に測定する新しい技術が求められていました。
【研究成果の概要】
本研究グループは、直径200 nm以下の極細の針(ナノニードル探針)を作製し、これを細胞に突き刺すようにスキャンすることにより細胞内部の構造を可視化・物性計測する「ナノ内視鏡AFM」技術(Penedo et al. Sci. Adv. 2021)をヒト肺がん細胞(PC9)の核の硬さ測定に応用する技術を開発し、次の現象を明らかにしました。
- 血清飢餓状態で核は硬くなり、上皮間葉転換(EMT)で柔らかくなる
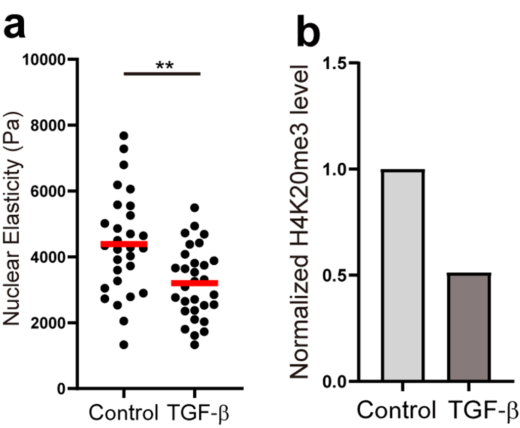
PC9を血清のない状態で培養すると核が硬くなり、その後、がんの転移を引き起こすEMTを誘導する薬剤(TGF-b)を添加すると、逆に核が柔らかくなることが分かりました。これは、がん細胞が転移能を獲得する過程で、狭い組織の間を通り抜けるために核を柔らかく変化させている可能性を示唆します。
- 核の硬さは、核膜のラミンではなくクロマチンの凝集状態と相関する
核の硬さを制御する因子として、核膜の内側を裏打ちするラミン線維と、DNAとタンパク質の複合体であるクロマチンが知られています。EMT誘導時にこれらの因子の変化を調べた結果、ラミンA/C、B1、B2の発現量に変化は見られませんでした。一方で、クロマチンの凝集マーカーであるヒストンH4の20番目のリジンのトリメチル化(H4K20me3)が、EMT誘導によって有意に減少していました。この結果は、核の硬さの変化が、クロマチンの凝集が緩むことによって引き起こされたことを強く示唆するものです。
【今後の展開】
本研究で確立されたナノ内視鏡AFMは、生きた細胞の中にある核の硬さを、これまでになく高い精度と空間分解能で測定できる唯一の技術です。今後、さまざまながん細胞で核の硬さを測定し、悪性度や薬剤感受性との関連を調べることで、核の硬さを指標とした新しいがんの診断法や治療法の開発に貢献することが期待されます。また、核だけでなく、ミトコンドリアなど他の細胞内小器官のナノ力学物性の計測にも応用可能であり、生命科学のさまざまな分野に新たな知見をもたらす可能性があります。
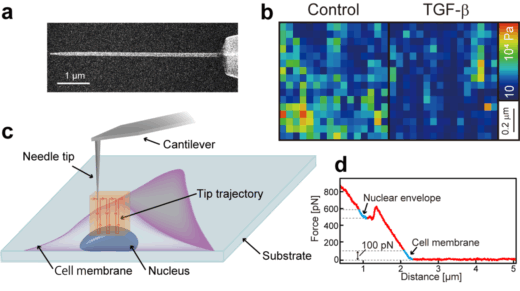
図1 (a)ナノニードル探針の電子顕微鏡写真。(b)核表面の1 ㎛四方の硬さ分布。(c)ナノニードル探針で生きた細胞の核膜の硬さを測定する模式図。(d)典型的なフォースカーブと細胞膜、核膜に相当する立ち上がり部分。
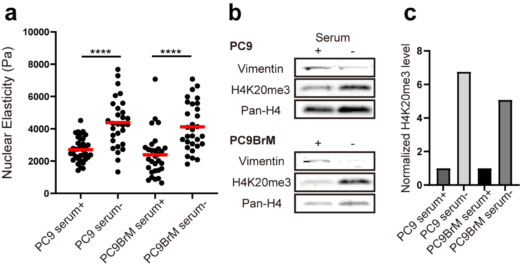
図2(a)肺がん細胞(PC9)と転移能がより高い肺がん細胞(PC9BrM)の血清がある場合、ない場合の核膜の硬さの違い。(b)Vimentin(中間径フィラメント)、H4K20me3(ヘテロクロマチンマーカー)、Pan-H4(ヒストンH4、コントロール用タンパク質)の発現量比較。(c)血清がある場合を1とした場合のH4K20me3の発現比率。
用語解説
掲載論文情報
- 論文タイトル
- Probing Nanomechanics by Direct Indentation Using Nanoendoscopy-AFM Reveals the Nuclear Elasticity Transition in Cancer Cells (ナノ内視鏡AFMを用いたがん細胞の核の硬さ変化直接測定)
- 著者
- Takehiko Ichikawa, Yohei Kono, Makiko Kudo, Takeshi Shimi, Naoyuki Miyashita, Tomohiro Maesaka, Kojiro Ishibashi, Kundan Sivashanmugan, Takeshi Yoshida, Keisuke Miyazawa, Rikinari Hanayama, Eishu Hirata, Kazuki Miyata, Hiroshi Kimura, and Takeshi Fukuma (市川 壮彦、河野 洋平、工藤 麻希子、志見 剛、宮下 尚之、前坂 智弘、石橋 公二朗、クンダン シバシャンムガン、吉田 孟史、宮澤 佳甫、華山 力成、平田 英周、宮田 一輝、木村 宏、福間 剛士)
- 掲載誌
- ACS Applied Nano Materials
- 掲載日
- 2025.10.12
- DOI
- 10.1021/acsanm.5c03044
- URL
- https://pubs.acs.org/doi/full/10.1021/acsanm.5c03044